Clostridium difficile ist ein grampositives, anaerobes, sporenbildendes Bakterium. Darmerkrankungen aufgrund von C. difficile betreffen bekanntermaßen verschiedene Spezies einschließlich Menschen, Schweine, Pferde, nichtmenschliche Primaten, Kaninchen, Ratten, Haushunde und Hauskatzen (Arroyo et al., 2005; Debast et al., 2009; Hopman et al., 2011; Keessen et al., 2011a; Norman et al., 2009).
Beim Schwein ist die C.-difficile-Infektion (CDI) eine der wichtigsten Darmerkrankungen bei Neugeborenen. CDI beim Schwein wird hauptsächlich bei 1-7 Tage alten Ferkeln festgestellt (Hopman et al., 2011; Songer and Anderson, 2006). Zu den klinischen Symptomen gehören gelber bis wässriger Durchfall und Verstopfung (Yeager 2007). Die Besiedlung des Darms mit C. difficile erfolgt in den ersten Lebensstunden und in einigen Betrieben ist diese Besiedlung bei fast 100 % der Ferkel innerhalb von 48 Stunden nach der Geburt zu beobachten (Hopman et al., 2011). Klinische Erkrankungen werden allerdings nur in bestimmten Fällen festgestellt. Die Übertragung erfolgt fäkal-oral und die Bakterien und Sporen sind innerhalb der Umgebung der Betriebe häufig endemisch. Es hat sich gezeigt, dass nur ca. 25% der getesteten Sauen C. difficile in der Laktationsperiode aktiv weiterverbreiteten (Norman et al., 2009). Aus anderen Studien geht hervor, dass die Luft und die Umgebung für neonatale Schweine die wichtigsten Quellen von C. difficile darstellen (Hopman et al., 2011). Die Sporen von C. difficile sind äußerst resistent gegenüber physikalischen und chemischen Wirkstoffen, die beispielsweise bei den Reinigungsverfahren in den Betrieben und den meisten Desinfektionsmitteln verwendet werden, (Fawley et al., 2007) und können viele Monate lang in der Umgebung überleben (Speight et al., 2011). Die Prävalenz von C. difficile unter Schweinen fällt mit dem Alter drastisch ab. Studien in verschiedenen Ländern zur Untersuchung der Prävalenz von C. difficile bei Schlachtschweinen zeigten eine durchweg niedrige Prävalenz, die von 0% bis 8% reichte (Baker et al., 2010; Hoffer et al., 2010).

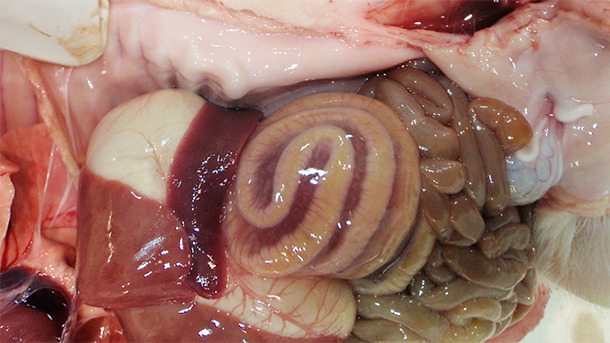
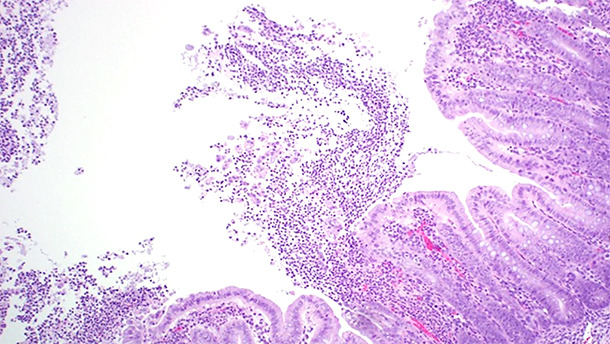
Obwohl sich die meisten C. difficile-Infektionen in der ersten Lebenswoche ereignen, belegten Arruda et al. (2013) in einer aktuellen Studie, dass 10 Tage alte Ferkel genauso anfällig sind wie neonatale Ferkel, wenn sie einem toxinogenem Stamm von C. difficile ausgesetzt wurden. Beschrieben wurden zahlreiche Virulenzfaktoren, die mit CDI in Verbindung gebracht werden, einschließlich Oberflächenproteinen und Exotoxinen, obwohl weithin anerkannt ist, dass die Exotoxine A und B (TcdA bzw. TcdB) die wichtigsten Virulenzfaktoren in Verbindung mit der Entstehung der Krankheit sind (Davies et al., 2011). Einige Stämme von C. difficile produzieren auch ein ADP-ribosylierendes binäres Toxin. Die Rolle, die dieses Toxin bei der Pathogenese der Krankheit spielt, ist jedoch noch nicht geklärt (Davies et al., 2011). Läsionen in Verbindung mit CDI konzentrieren sich vor allem auf den Dickdarm. Ein Ödem im Mesocolon (Abb. 1) ist die klassische makroskopisch sichtbare Läsion, die bei CDI festgestellt wird. Diese Läsion ist jedoch nicht krankheitskennzeichnend. Yaeger et al. zeigten, dass ein Ödem im Mesocolon bei Ferkeln kein guter Prädiktor für C. difficile-Toxine ist (Yaeger et al., 2007). Histopathologische Untersuchungen von erkrankten Tieren zeigten eine multifokale bis lokal ausgedehnte fibrinopurulente Colitis ulcerosa (Abb. 2).
Man geht davon aus, dass viele Risikofaktoren einschließlich der Gabe von Antibiotika, der Provokationsdosis, des Profils assoziierter Toxine und des Alters zu CDI beitragen. In einer jüngsten Studie wurde belegt, dass die Provokationsdosis in direktem Zusammenhang mit der Schwere der Erkrankung steht. Ergebnisse der gleichen Studie deuten darauf hin, dass die Behandlung mit Antibiotika am ersten Tag nach der Geburt keine wichtige Rolle bei der Entwicklung und/oder Schwere von CDI-Läsionen bei Ferkeln spielt (Arruda, et al., 2013). Dies könnte darauf zurückzuführen sein, dass durch die noch nicht ausgebildete Darmflora bei neonatalen Ferkeln die Auswirkungen der Antibiotika auf die Darmflora eingeschränkt werden (Arruda, et al., 2013). Die Mortalität in Verbindung mit Ausbrüchen von CDI-Infektionen ist zwar unterschiedlich hoch, allerdings wurde von Sterberaten berichtet, die bei 16% lagen (Anderson and Songer, 2008). Bei genesenen Ferkeln wurden Wachstumsretardierungen und ein geringeres Absetzgewicht beschrieben, das ca. 0,5 kg unter dem Durchschnitt lag (Songer, 2004).
Die Diagnose von CDI kann aufgrund der endemischen Natur dieses Bakteriums schwierig sein. Die einfache Isolierung des Bakteriums oder der Toxinnachweis (ELISA) reichen zum Beispiel nicht aus, um die Krankheit zu diagnostizieren. Um CDI bei Ferkeln richtig zu diagnostizieren, wird ein mehrstufiges Diagnoseverfahren einschließlich der Identifizierung potentieller Erkrankungen (Krankengeschichte), ELISA-Tests zum Nachweis von Toxinen und der histologischen Untersuchung von Dickdarmabschnitten empfohlen.
Bisher gibt es keine zugelassenen und im Handel erhältlichen Produkte zur Vorbeugung und/oder Behandlung von CDI bei Ferkeln. Es hat sich herausgestellt, dass die Expositionsdosis in direktem Zusammenhang mit der Schwere der Erkrankung steht, weshalb Praktiken, die die Expositionsdosis für neonatale Ferkel verringern, die klinische Erscheinung der Krankheit verhindern und/oder minimieren könnten. Schließlich hat sich gezeigt, dass der Einsatz von nicht-toxigenem C. difficile (NTCD) als Probiotikum die Schwere histologischer Läsionen und die Menge an Toxinen, die bei neonatalen Ferkeln nachgewiesen werden, reduzieren kann (Arruda et al., 2016). Abschließend gibt es trotz der Wichtigkeit von CDI bei neonatalen Ferkeln immer noch große Wissenslücken bezüglich der grundlegenden Prinzipien der Epidemiologie, der Pathogenese und der Vorbeugung beim Schwein.




