Stress wird im Allgemeinen als biologisches Phänomen definiert, das in der Reaktion eines Organismus auf übermäßige körperliche oder geistige Belastungen besteht. Stress löst das allgemeine Anpassungssyndrom (AAS) aus, das durch eine spezifische hormonelle Aktivität und pathologische Veränderungen gekennzeichnet ist. Das wichtigste Anzeichen für eine Stressreaktion ist eine erhöhte Ausschüttung von Glykosteroiden aus der Nebennierenrinde.
In der intensiven Schweinehaltung kann Stress durch Störungen verursacht werden, z. B. im Zusammenhang mit einer zu hohen Tierdichte, häufigen Verlegungen oder langen Transporten, die das Gleichgewicht zwischen der Umwelt und den Tieren stören (Nawroth et al., 2019). Aufgrund der Zusammenhänge zwischen verschiedenen physiologischen Mechanismen kann sich Stress nicht nur negativ auf die Immunität und damit auf die Gesundheit, sondern vor allem auf die Fortpflanzung auswirken (Dobson et al., 2000).

Es gibt zwei Reaktionen auf Stress, die vom Verhalten des betroffenen Individuums abhängen: eine aktive Reaktion, d. h. Angriff oder Flucht, und eine passive Reaktion, die bei länger anhaltendem Stress in Unbeweglichkeit und Depression besteht (Henry und Stephens, 2013). Der Adrenalin- und Noradrenalinrausch ist charakteristisch für eine aktive Reaktion. Bei einer passiven Reaktion wird ein erhöhter Spiegel an Kortikosteroiden beobachtet (Menash, 2013).
Einfluss von Stress auf die Immunreaktion
Die Mechanismen im Zusammenhang mit Stress, die seine Auswirkungen auf das Immunsystem bestimmen, sind noch nicht vollständig geklärt. Die gegenseitige Beeinflussung von Nerven- und Immunsystem ist jedoch weitgehend bekannt. Die wichtigsten Bahnen, die an diesen Wechselwirkungen beteiligt sind, sind die Achse des sympathischen Nervensystems (SNS) und die Hypothalamus-Hypophysen-Nebennieren-Achse (HHN-Achse). Diese Systeme kommunizieren über zwei Achsen miteinander. An der SNS-Achse sind das sympathische Nervensystem und das Nebennierenmark beteiligt. Das sympathische Nervensystem ist Teil des autonomen Nervensystems, das die inneren Organe aktiviert und für die Kampf-oder-Flucht-Reaktion verantwortlich ist (Tindle and Tadi, 2022).
Abbildung 1 veranschaulicht die Reaktion eines Schweins, wenn das sympathische System durch einen akuten Stressor aktiviert wird. Die Aktivierung des Sympathikus bei Schweinen kann durch Chromogranin A (CgA) gemessen werden, ein saures lösliches Protein, das zur Familie der Granine gehört (Escribano et al., 2013).

Abbildung 1: Nachdem ein Stressor ausgelöst wurde, stimuliert der Sympathikus die Nebennieren zur Ausschüttung von Adrenalin und Noradrenalin. Die Aktivierung des Sympathikus bei Schweinen kann durch Chromogranin A (CgA) gemessen werden.
Die andere Achse, die HHN-Achse, wird Minuten oder Stunden nach dem Auftreten von Stress aktiviert (Lightman, 2008), wie in Abbildung 2 zu sehen ist. Das durch diese Stressreaktion produzierte Cortisol dient bei Schweinen häufig als Stressmarker sowie als nichtinvasiver Test für Speichel (Hillman et al., 2008; Ruis et al., 1997; Valros et al., 2013).
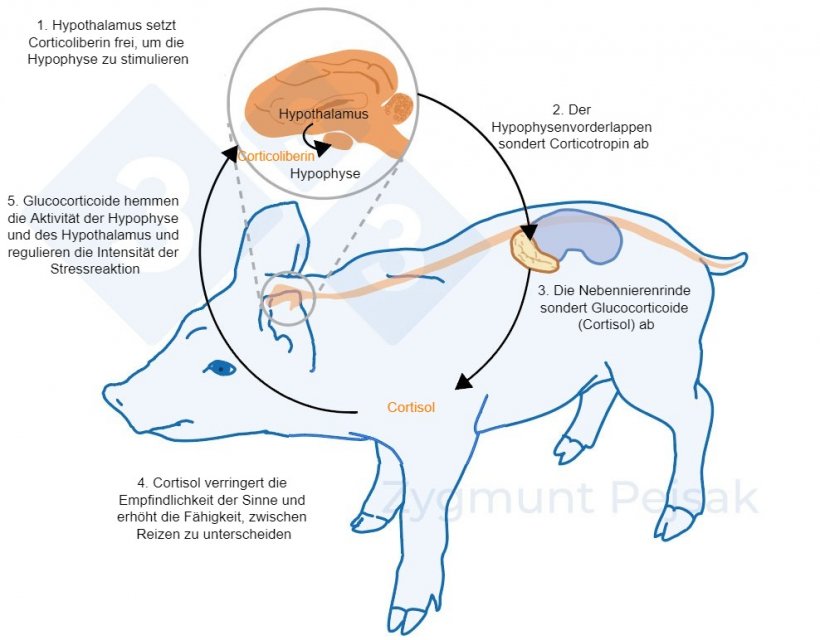
Abbildung 2: Wenige Minuten oder Stunden nach dem Auftreten von Stress wird die Hypothalamus-Hypophysen-Nebennieren-Achse (HHN-Achse) aktiviert. Die Hypophyse schüttet Corticotropin aus, das in der Nebennierenrinde zur Ausschüttung von Glucocorticoiden, einschließlich Cortisol, führt. Glucocorticoide hemmen die Aktivität der Hypophyse und des Hypothalamus, wodurch sie die Intensität der Stressreaktion regulieren. Cortisol dient bei Schweinen häufig als Stressmarker sowie als nichtinvasiver Test für Speichel.
Glucocorticoide haben eine negative Wirkung auf das Immunsystem. Sie können sich auf die angeborene Immunantwort auswirken, indem sie die Zahl der zirkulierenden Monozyten und damit auch proinflammatorische Zytokine verringern. Glucocorticoide hemmen den Leukozytenverkehr und damit den Zugang der Leukozyten zum Entzündungsherd (Strehl et al., 2019). Starker und lang anhaltender Stress hemmt die humorale und zelluläre Reaktion des Immunsystems, was zu einer „Hyperadaptose“ führt, die oft die Manifestation einer Krankheit zur Folge hat (Wrona-Polanska, 2008). Einzelheiten zu den Auswirkungen sind in Abbildung 3 dargestellt. In der Zwischenzeit induziert ein kurzer psychologischer Stress, wie die soziale Isolation von Ferkeln, einen Zustand der Cortisolresistenz in den Immunzellen des Blutes, was eine Anpassung sein könnte, die darauf abzielt, die zellulären Immunreaktionen kurzfristig aufrechtzuerhalten (Escribano et al., 2013).
Tabelle 1: Es gibt zwei Reaktionen auf Stress: eine aktive Reaktion, d. h. Angriff oder Flucht, und eine passive Reaktion, die in Unbeweglichkeit und Depression bei länger anhaltendem Stress besteht.
| Kurzer Stress: aktive Reaktion | Anhaltender Stress: passive Reaktion |
|---|---|
| Eine kurze psychische Belastung führt zu einem Zustand der Cortisolresistenz in den Immunzellen des Blutes. | Glucocorticoide haben eine negative Wirkung auf das Immunsystem: |
|
↑ CD8+-Lymphozyten ↓ CD4+/CD8+-Verhältnis |
↓ Zirkulierende Monozyten ↓ Proinflammatorische Zytokine IL-2, IL-6, TNF-α und IL-12 ↓ Differenzierung der Th1-Lymphozyten ↓ T-Zellen ↓ IL-2 (notwendig für T-Zellen) ↓ Leukozytenverkehr ↓ Humorale Reaktion ↓ Zelluläre Reaktion ↓ Reaktivität der Lymphozyten ↓ Produktion von Lymphozyten (manchmal sogar Aktivierung des Prozesses ihrer Apoptose) |
Es gibt einige Immun-Biomarker, die sich unmittelbar nach Stress verändern und daher leicht als Biomarker für akuten Stress dienen könnten (Puppe et al., 1997). Dazu gehören:
- Ein erhöhtes Neutrophilen/Lymphozyten-Verhältnis
- Serumamyloid A des Speichels
- Immunglobulin (IgA)
- IL-18
Akuter Stress wird in der Regel mit einer proinflammatorischen Reaktion in Verbindung gebracht, die für die Einstellung des Immunsystems auf Kampf und Heilung hilfreich sein kann (Dhabhar et al., 1995). Im Allgemeinen verringert chronischer oder wiederholter Stress die Immunreaktionen, während eine einmalige Stressbelastung die Immunität stärkt (Dhabhar, 2009). Dies wird auch durch Studien zur angeborenen Immunität bei Schweinen bestätigt. Die endgültige Wirkung eines Stressors hängt jedoch auch von den Stressfaktoren ab. Tabelle 2 enthält eine Liste akuter und chronischer Stressfaktoren und deren Reaktionen bei Schweinen. Die Tabelle zeigt auch, dass die Auswirkungen von Stress auf die Immunreaktion auch Individuen in utero beeinflussen können.
Tabelle 2: Die Stressreaktion hängt vom Stressfaktor ab.
| Stressfaktor | Antwort | Studie | |
|---|---|---|---|
 |
Kurzer Transport (20 Minuten) |
↑ einige Akute-Phase-Proteine (APP), Haptoglobin und CRP ↑ Neutrophile/Lymphozyten-Verhältnis |
Dhabhar, 2009; Puppe et al., 1997 |
|
|
Langer Transport (mehr als 6 Stunden) |
↑ Proinflammatorische Zytokine (IL-2, IL-6, IL-12, IL-1β, und IFN-γ) ↓ Antiinflammatorisches Zytokin IL-4 |
De et al., 2021 |
|
|
Akuter Immobilisationsstress |
Stimulation des SNS ↑ IL-18 im Speichel |
Piñeiro et al., 2007 |
|
Isolierung junger Ferkel |
↑ IL-6 mRNA im Hypothalamus |
Tuchscherer et al., 2004 |
|
|
Wiederholte soziale Isolation von Ferkeln |
↑ Zytokine (IL-1β) |
Kanitz et al., 2004; Tuchscherer et al., 2004 |
|
|
|
Sozialer Stress |
Unterdrückung der Immunreaktion auf einen viralen Impfstoff und folglich Verminderung des Schutzes gegen eine Infektion bei dominanten Individuen stärker als bei rangniederen Individuen, die sozialem Stress ausgesetzt sind |
Groot et al., 2001 |
|
Chronischer sozialer Stress |
Immunsuppressive Wirkung Signifikante Verringerung der proinflammatorischen Zytokine (TNF-α, IL-1β und IL-8), wahrscheinlich aufgrund einer starken Erhöhung der IL-10-Expression im Ileum und Kolon |
Bennett et al., 2015 |
|
|
|
Anhaltender Stress in Verbindung mit Unterbrechungen der Nahrungsaufnahme |
↑ APP, insbesondere bei männlichen Tieren |
Muneta et al., 2011 |
|
|
Fötaler Hitzestress (in utero) |
↑ Zytokinreaktion (TNF-α, IL-1β und IL-6) auf Lipopolysaccharid (LPS) bei Föten in utero im Vergleich zu Föten, die keinem Hitzestress ausgesetzt sind, wahrscheinlich aufgrund einer veränderten Stoffwechsel- und Cortisolreaktion |
Johnson et al. 2020 |
|
Chronische Hitzebelastung |
Keine Auswirkung auf die Proliferation von Lymphozyten |
Bonnette et al., 1990; Morrow-Tesch et al., 1994 |
|
|
14-tägige Exposition gegenüber Stress durch Hitze und Gedränge |
↑ Proliferation von T-Zellen und Zytotoxizität der NK-Zellen Keine Auswirkung auf die Gesamt-IgG-Konzentration |
Sutherland et al., 2006 |
|
|
|
4 Tage Kältestress |
↓ NK-Aktivität ↓ Proliferation von T-Zellen ↓ Gesamtplasma-IgG-Konzentration |
Salak-Johnson et al., 2018 |
|
|
Maternaler Stress |
↓ Serum-IgG-Spiegel bei Saugferkeln und Immunsuppression der B- und T-Zellproliferation Keine Veränderung der Zytotoxizität der NK-Zellen ↓ Gewicht des Thymus |
Tuchscherer et al., 2002 |
It seems that the ultimate effect of stress on the immune system Es scheint, dass die letztendliche Auswirkung von Stress auf das Immunsystem nicht nur von der Dauer des Stresses und den Stressoren abhängt, sondern auch von dem Individuum, das diesem Stress ausgesetzt ist. Sozialer Stress scheint die Immunreaktion auf einen viralen Impfstoff zu unterdrücken und folglich den Schutz gegen eine Infektion bei dominanten Tieren stärker zu beeinträchtigen als bei rangniederen Tieren, die sozialem Stress ausgesetzt sind (Groot et al., 2001). Generell zeigten sozial dominante und sich unterordnende Schweine im Vergleich zu durchschnittlichen Schweinen Veränderungen in der Immunfunktion (erhöhte Neutrophilenzahl und verminderte Antikörperproduktion). Hitze und sozialer Stress interagieren in ihrer Wirkung auf das Immunsystem des Schweins und verursachen eine Immunsuppression bei durchschnittlichen Tieren, obwohl es auch immunologische Kosten für dominante Schweine gibt (Mc Kim et al., 2018).
Stress wird auch mit Stereotypien und sogar destruktiven Störungen wie Schwanzbeißen in Verbindung gebracht, denen durch die Zurverfügungstellung von Beschäftigungsmaterial entgegengewirkt werden kann (D'Eath et al., 2004). Interessant ist, dass das Beschäftigungsmaterial auch bestimmte Komponenten des Immunsystems beeinflussen kann (Luo et al., 2017; Manciocco et al., 2011; Reimert et al. 2014; Scollo et al., 2013; Scott et al., 2006). Einige Daten weisen auf niedrigere N:L-Verhältnisse und Haptoglobinwerte bei Schweinen in Ställen hin, die über Beschäftigungsmaterial verfügten, was darauf schließen lässt, dass sie weniger gestresst sind und ihr Immunsystem weniger aktiviert ist (Beattie et al., 2000). Diese Ergebnisse bestätigen den Zusammenhang zwischen Stress und dem Immunsystem sowie die positiven Auswirkungen von Beschäftigungsmaterial auf das Verhalten und das Wohlergehen der Schweine. Es sollte betont werden, dass eine kurzfristige Aktivierung des Immunsystems und eine proinflammatorische Reaktion von Vorteil sein können, auch wenn sie langfristig negative Auswirkungen haben.













