Angesichts der hohen Prävalenz von PCV-2 sowohl bei gesunden als auch kranken Tieren, sind die derzeit duchgeführten serologischen Tests als diagnostischer Nachweis gegen diesen Krankheitserreger vermehrt in Frage gestellt worden. Es ist bekannt, dass die Diagnose "Circovirose" in Anlehnung an Sordens Kriterien zur Definition dieser Erkrankung erfolgen muss. Nichtsdestotrotz haben serologische Tests ihre Berechtigung. wobei jedoch die Art des Tests, seine Verfügbarkeit und die Gegebenheiten oder Bedingungen berücksichtigt werden müssen, in denen wir sie anwenden möchten. Außerdem hängt die Auswahl der Tests von der Zielsetzung ab.
Da der indirekte Immunfluoreszenz-Assay (IFA) in unserem Umfeld nicht eingesetzt wird und der Immunperoxidase Monolayer Assay (IPMA) fast ausschließlich aufgrund seiner Fehleranfälligkeit und der damit eingeschränkten Nutzbarkeit auf den wissenschaftlichen Bereich beschränkt ist, werden wir sie in diesem kurzen Überblick nicht erwähnen. Wir möchten nur darauf aufmerksam machen, dass der letztgenannte Test für einige Experten als Referenztest gilt, wenn immunenzymatische Tests oder ELISA evaluiert werden.

ELISA Testsysteme
Zwischen den verfügbaren ELISA Tests können wir zwei Hautgruppen unterscheiden:
- Die Blocking ELISAs, mit denen IgM- und IgG- Antikörper nachgewiesen werden können.
- Die indirekten ELISAs, welche die Gesamtmenge der Antikörper bestimmen.
Blocking ELISA
Derzeit ist ein kommerzielles Kit erhältlich, dessen Einsatz sich in folgenden Fällen sehr gut eignet:
- Nachweis des Infektionszeitpunktes und der Viruszirkulation, vorausgesetzt die Tiere sind nicht bzw. mit einem Impfstoff geimpft, welcher nur eine geringe oder eine nicht durch diesen Test nachweisbare Immunantwort auslöst.
- Das Verhältnis zwischen den IgM und IgG-Mengen (0% der Tiere mit positiver Reaktion) ermöglicht die Bestimmung des Infektionszeitpunktes sowie den Beginn der Viruszirkulation (siehe Grafik 1).
Grafik 1.- Verlauf der IgG und IgM Antwort gemessen mittels Blocking ELISA (INGENASA) sowie PCV2-Virämie nach experimenteller Exposition (Segalés et al. 2005).
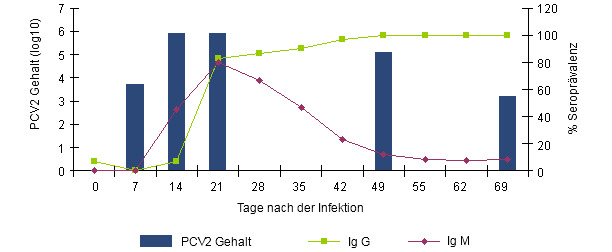
IgM Immunglobuline sind zwischen dem 7. und 14. Tag post infectionem und eine Woche vor den IgG Immunglobulinen nachweisbar. Drei Wochen post infectionem ist die Seroprävalenz beider Immunglobuline gleich stark ausgeprägt. Während die nachweisebare Serumkonzentration von IgG konstant bleibt, reduziert sich der Gehalt von IgM nun allmählich. Das Verhältnis der Antikörperklassen untereinander zeigt uns den Zeitraum an, welcher seit der Infektion vergangen ist.
- Verlaufsuntersuchungen über die Viruszirkulation in den unterschiedlichen Altersklassen bei klinisch erkrankten als auch subklinisch infizierten Tieren (Grafik 2).
Grafik 2.- Serumprofil (Querschnittsuntersuchung) eines Betriebes mit PCV2-Klinik, in dem nicht gegen PCV2 geimpft wird.
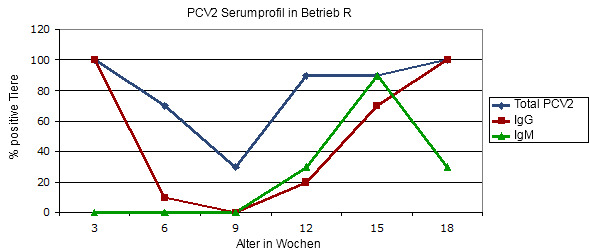
Betrieb mit PMWS-Problematik bei Tieren ab der 10. Lebenswoche. Der Gesamtantikörpergehalt gibt uns zunächst eine Information über die maternale Immunität und über die anschließende Serokonversion post infectionem. Die unterschiedlichen Altersgruppen können geringgradig voneinander abweichende Infektionszeitpunkte haben. Zur Interpretation dieser Grafik empfiehlt sich ein Blick auf Abbildung 1.
Bei der Interpretation der Ergebnisse müssen wir vorsichtig sein, da, wie bereits erwähnt, eine Infektion nicht mit einer Erkrankung gleichzusetzen ist, besonders wenn die Tiere zuvor geimpft wurden. Zum anderen haben diese Tests aufgrund der hohen Prävalenz von PCV2 eine geringe Aussagekraft bei adulten Sauen, sodass deren Anwendung normalerweise auf Ferkel und Mastschweine begrenzt ist.
Indirekter ELISA
In Hinblick auf die "Gesamtantikörper-Tests" sind eine Reihe an kommerziell verfügbaren Tests vorhanden bzw. werden von den Labors, welche die Untersuchungen durchführen, angeboten. Sie eignen sich (Grafik 2):
- zur Nachuntersuchung der maternalen Immunität und der späteren Analyse der Beeinträchtigung, die durch diese verursacht wird.
-
als Ergänzung zum IgG/IgM Test in Serumprofilen.
-
zur Beurteilung des Immunstatus der Sauen und der Ferkel (Kolostrumaufnahme).
- schließlich zum Nachweis der PCV2-Impfung1, abhängig von der Art der verwendeten Vakzine und des eingesetzten Diagnostikkits (Grafik 3).
Grafik 3.- Serumprofil (Querschnittsuntersuchung) beim Absetzen gegen PCV2 geimpfter Ferkel: zwei indirekte ELISA Tests für Gesamtantikörper im Vergleich.
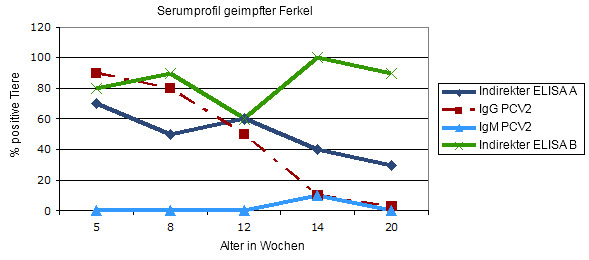
Die IgG-Antwort zeigt den Verlauf maternaler Antikörper an und/oder eine kurzzeitige Serokonversion nach der Impfung. Die IgM-Immunglobuline bleiben auf dem Basalwert. Die indirekten Assays verhalten sich unterschiedlich: Während Test A zunächst einen abnehmenden Verlauf der maternalen Immunität und eine schwächeren Antwort im Hinblick auf die Impfung zeigt, ist Test B sensitiver, da er die Impfantwort deutlich widerspiegelt. Offensichtlich messen die Tests unterschiedliche Antikörperklassen.
In Bezug auf diese Tests ist es wichtig zu wissen, dass sie nicht in Zusammenhang mit dem Grad des Schutzes bei geimpften Tieren stehen. Einige Impfstoffe führen zu keiner Antwort oder zu einer uneinheitlichen Antwort in diesen Tests,, ohne dass dies als Zeichen eines fehlenden Schutzes gewertet werden kann.
Zum anderen ist es nicht ungewöhnlich, dass unterschiedliche kommerzielle Tests zu verschiedenen Ergebnissen führen (Aleff et al. 2007). Somit ist es zum Beispiel möglich, dass ein Assay nur schwache oder uneinheitliche Ergebnisse liefert, während ein anderer uns erlaubt, die Impfantwort genau zu messen (Grafik 3). Deshalb kann die Nichtbeachtung dieser Tatsache zu fehlerhaften Interpretationen führen. Im Gegensatz dazu kann eine gute Kenntnis über den serologischen Assay und der Gebrauch unter den oben aufgeführten Rahmenbedingungen eine große Hilfe sein, um die epidemiologische oder die Impfsituation zu bestimmen und um geeignete Maßnahmen zu ergreifen. Immer, wenn es zur Interpretation von serologischen Ergebnissen kommt, sollte in jedem Falle Wert auf ein gutes Probennahmeschema gelegt werden. Weiterhin sollte der Vorbericht der Tiere bekannt sein und die Beratung bezüglich der Verwendung und der Interpretation eines jeden Assays, durch eine Person mit Fachwissen erfolgen.
Abschliessend soll hervorgehoben werden, dass, obwohl wir häufig über "Titer" sprechen, die Mehrzahl der Tests "qualitativ" ist. Das bedeutet, dass Werte, die einen bestimmten Grenzwert überschreiten, als positiv bewertet werden und jene, die unterhalb dieses Grenzwertes sind, als negativ bewertet werden. Deshalb kann der Versuch einer quantitativen Interpretation aus diesen Werten frustrierend oder zumindest verwirrend sein. Als Alternative schlagen einige Anbieter vor, die Analyse derselben Probe in verschiedenen Platten durchzuführen, wodurch ein "semiquantitatives" Ergebnis mit Hilfe einer entsprechenden mathematischen Berechnung erreicht werden kann. Andere Personen erstellen einen Verhältnis- oder Indexwert, verschiedentlich als S/P-Ratio bezeichnet. Dieser Wert errechnet sich aus dem "Verhältnis zwischen dem Ausgabewert der Probe (englisch: sample =S) und der positiven Kontrolle (=P), nachdem wir von beiden die negativen Kontrollwerte abgezogen haben". In anderen Fällen wird der Ausgabewert der Platte mit einer Standardtabelle mit positiven Kontrollwerten verglichen. Manchmal wird eine mathematische Formel bei dem Ausgabewert der optischen Dichte angewandt, um daraus einen Titer zu errechnen, welcher normalerweise durch eine Parallelanalyse mit einem Referenztest erzeugt würde (Segalés et al. 2011).
Diese Fakten machen es notwendig, bei der Bewertung von Ergebnissen, die auf quantitativen Methoden beruhen vorsichtig zu sein, dennoch abhängig von der gewählten Methode und dem Ziel der Untersuchung können sie durchaus hilfreich sein.
1 Es wurde ein spezifischer ELISA-Test entwickelt, um die Impfung eines bestimmten kommerziellen PCV2-Impfstoffes nachzuweisen. Dieser Test basiert auf der Antikörperantwort gegen das Baculovirus.



