Brachyspira hyodysenteriae ist der wichtigste Krankheitserreger der Schweinedysenterie. Als weitere primäre Krankheitserreger, die auch zur Schweinedysenterie führen, wurden außerdem zwei andere Spezies von Brachyspira identifiziert: B. suanatina (Rasback et al., 2007) und B. hampsonii, Genomovare I, II und III (Mirakjar et al., 2016). Die Krankheit führt zu starker mukohämorrhagischer Diarrhö und infolgedessen zu massiven wirtschaftlichen Verlusten für die Schweineproduktion. Zu den makroskopisch sichtbaren Läsionen gehören unterschiedliche Grade mukosaler Verdickung, multifokale Hämorrhagie, Nekrose in Verbindung mit fibrinösem Exsudat und variable, aber häufig übermäßige Mengen luminalen Schleims im Dickdarm (Hampson, 2012). Die Schweinedysenterie ist weltweit verbreitet und kommt hauptsächlich in den Regionen mit der höchsten Schweinebesatzdichte vor (Calderaro et al., 2001). Obwohl die Krankheit in den letzten 20 Jahren in nordamerikanischen Schweinebetrieben nicht auftrat, wird seit 2008 hauptsächlich aufgrund des Managements der Produktionssysteme von verschiedenen Fällen in den Vereinigten Staaten und Kanada berichtet (Chander et al., 2012). Jüngste Studien beschreiben Fälle in Europa (Dors et al., 2015; Löbert et al., 2016) und in Asien (Kajiwara et al., 2016). In Brasilien wurde die Schweinedysenterie zwischen den 1980er und den 1990er Jahren in sporadischen Berichten von kleinen Betrieben, in sehr wenigen epidemiologischen Studien oder in Verbindung mit der Optimierung der Diagnoseverfahren beschrieben (Barcellos et al., 2000). Seit 2010 wurde in verschiedenen brasilianischen Bundesstaaten in den Regionen, in denen sich der größte Teil der Schweineproduktion konzentriert, von SD-Ausbrüchen berichtet, die zu großen wirtschaftlichen Schäden führten (Daniel and Guedes, 2013).
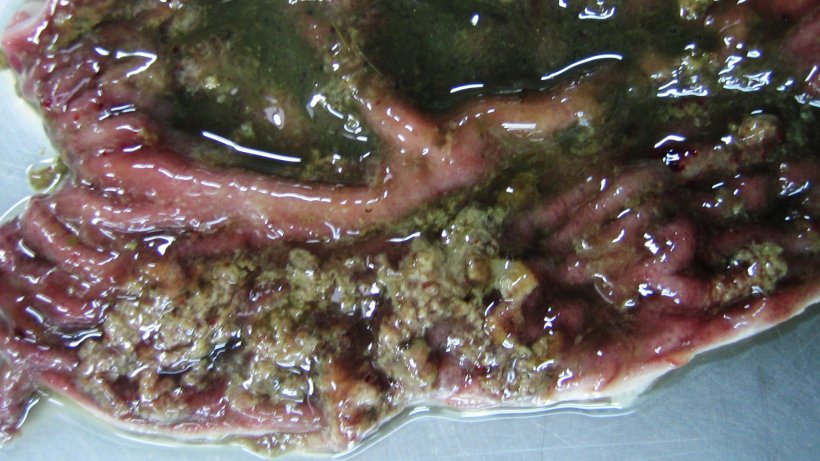
Dickdarm eines 10 Wochen alten Schweins mit Schweinedysenterie: Oberflächliche Nekrose der Schleimhaut in Verbindung mit leichter Hämorrhagie und katarrhalischem Inhalt

In einigen Fällen wurde von B. hyodysenteriae Stämmen mit niedriger Pathogenität berichtet, die sich ansiedeln, aber nicht zur klinischen Erkrankung führen (Lyson et al., 1982; Thomson et al., 2001). Trotz des ungeheuren Aufwands, den die Wissenschaftler betreiben (Song et al., 2009; Jiang et al., 2014; Singh et al., 2015), gibt es derzeit noch keinen im Handel erhältlichen Impfstoff gegen B. hyodysenteriae. Für diese beiden Phänomene gibt es verschiedene Erklärungen, aber eine der relevantesten beruht auf der immensen genetischen Vielfalt, die innerhalb der Spezies B. hyodysenteriae zu beobachten ist. Man vermutet, dass viele pathogene Faktoren für die Manifestation der Virulenz maßgeblich sind. Beispielsweise wird die hämolytische Aktivität häufig als wichtiger Faktor beschrieben. Mahu et al. (2016) sequenzierten sieben Gene von Hämolyse-assoziierten B. hyodysenteriae Stämmen, die bei Schweinen mit leichter bis starker mukohämorrhagischer Diarrhö gefunden wurden. Ein schwach hämolytischer Stamm zeigte Sequenzänderungen bei fünf dieser Gene. Während eines routinemäßigen Screenings fäkaler Proben von einem Aufzuchtbetrieb traten vor Kurzem jedoch widersprüchliche Ergebnisse zu Tage. Dieser spezielle Betrieb benutzte keine antimikrobiellen Substanzen und hatte keine früheren Fälle von Schweinedysenterie aufzuweisen. Beim routinemäßigen Screening des Betriebs wurden jedoch einige Tiere durch PCR positiv auf B. hyodysenteriae getestet und am Ende gelang es uns, das Bakterium zu isolieren. Vorläufige Ergebnisse eines Provokationstests mit diesem Isolat belegten im Vergleich zu einem bekannten pathogenen Stamm eine niedrige, aber eindeutige Pathogenität des Isolats (Sato et al., 2016). Es muss erwähnt werden, dass dieser gering pathogene Stamm in vitro stark hämolytisch war. Diese Befunde schwächen die Annahme, dass hämolytische Gene wichtige Marker für die Pathogenität von B. hyodysenteriae Stämmen sind.

Katarrhalische hämorrhagische Diarrhö
Jüngste Studien (Song et al., 2015; Hampson et al., 2016) zeigen die Anstrengungen, die unternommen werden, um mithilfe von rekombinanten Proteinen einen serologischen Test zu entwickeln, um vor allem das Problem von subklinisch mit B. hyodysenteriae infizierten Betrieben anzugehen. Dies könnte ein künftiges wichtiges Mittel sein, um Betriebe ausfindig zu machen, die B. hyodysenteriae positiv sind, aber keine klinischen Symptome von Schweinedysenterie aufweisen. Die genetische Variation und bedeutende Unterschiede bei antigenischen Proteinen stellen jedoch beträchtliche Einschränkungen für die Entwicklung eines weltweit einsetzbaren serologischen Tests dar.
Was kann ein Tiermediziner aus Sicht der Praxis bei einem Zucht- oder einem anderen kommerziellen Betrieb, der positiv auf gering pathogene B. hyodysenteriae getestet wurde, dennoch tun? Zuerst würden wir nur aufgrund der positiven Ergebnisse der Diagnosetests wie beispielsweise PCR, qPCR, der bakteriellen Isolierung und/oder eventuell erst in Zukunft zum Einsatz kommender serologischer Tests in Verbindung mit fehlenden klinischen Symptomen davon ausgehen, dass es sich um einen gering pathogenen Stamm handelt. Denken Sie daran, dass es noch keinen speziellen Marker für die Pathogenität gibt! Würde dieser Stamm pathogen werden, wenn er in einen gewerblichen Betrieb gelangt, in dem es Probleme bezüglich des Durchlaufs der Schweine, der Hygiene, der Schweinebesatzdichte etc. gibt? Sollten Aufzuchtbetriebe routinemäßig durch molekulare oder serologische Untersuchungen fäkaler Proben auf B. hyodysenteriae untersucht werden? Oder sollte man im Betrieb einfach nur strikte, routinemäßige klinische Bewertungen der Diarrhö-Erkrankungen durchführen und Proben von jeglichem auffälligen fäkalen Material entnehmen, um es vom Labor untersuchen zu lassen? Sollte der Betrieb geschlossen werden, bis man die Ergebnisse erhält? Zum jetzigen Zeitpunkt sind noch sehr viele Fragen bezüglich der gering pathogenen Stämme von B. hyodysenteriae zu klären und die meisten dieser Fragen betreffen in direkter Weise die tägliche Routinearbeit der Tierärzte, insbesondere derjenigen, die mit der Gesundheitssicherung von Aufzuchtbetrieben verbunden ist. Es besteht ein dringender Bedarf nach einem besseren Verständnis gering pathogener B. hyodysenteriae Stämme. Bis wir allerdings bessere Antworten haben, ist es hilfreicher, strikte routinemäßige klinische Auswertungen mit anschließender Probenahme aller auffälligen Fälle vorzunehmen und den Betrieb bis zum Erhalt der Ergebnisse zu schließen.






