Das Influenza A-Virus (IAV) ist die Ursache für ökonomisch bedeutsame respiratorische Erkrankungen bei Schweinen weltweit. Durch Reassortment und Mutation wurde die Virusökologie zunehmend komplexer, gleiches gilt auch für die verfügbaren Probenarten und diagnostische Nachweismethoden.
Es gibt diagnostische Testverfahren sowohl für den Nachweis einer aktiven Influenzainfektion als auch für einen zurückliegenden Kontakt mit dem Virus. Der direkte Test soll eine Virusreplikation und Vermehrung nachweisen, die zwischen 1-8 Tage post infectionem stattfindet. Eine Antikörperantwort dagegen kann 7-21 Tage nach Kontakt mit dem Virus nachgewiesen werden. Hier wird idealerweise eine gepaarte Serumprobe in einem Abstand von 2-4 Wochen durchgeführt. Jegliche Probenart sollte gekühlt bei einer Temperatur von 4°C innerhalb von 48 Stunden an ein diagnostisches Labor geschickt werden (Abbildung 1).

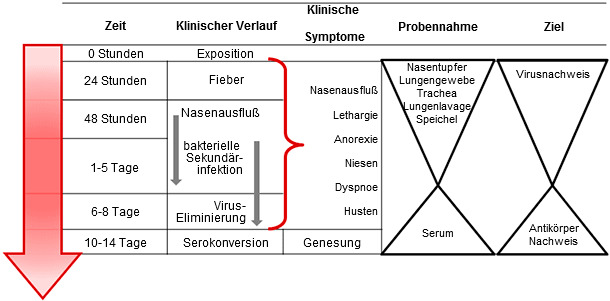
Abbildung 1. Die gerichtete Probennahme für den direkten oder indirekten Nachweis einer Influenza A-Infektion. Für den direkten Nachweis sollte die Probennahme während der Virusvermehrung in der frühen Phase der klinischen Erkrankung erfolgen. Der Nachweis von Antikörpern erfolgt nach der Eliminierung des Virus und hat als Reaktion auf die Infektion gebildete Antikörper zum Ziel.
Zu den üblichen Nachweismethoden zählt die Real-time Reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR). Sie wird in vielen Laboren zum Nachweis einer Influenzainfektion aus ante- oder post-mortem-Proben (beispielsweise Speichelproben, Nasentupfer oder Lungengewebe) genutzt. Die RT-PCR ist eine schnelle, sensitive und spezifische Nachweismethode mit einer schnellen Turn-around-time. Sie basiert auf dem Nachweis von genetischem Material/ RNA des IAV. Außerdem kommt die RT-PCR beim Nachweis der verschiedenen Subtypen zum Einsatz, es kann also eine Aussage darüber getroffen werden, ob es sich um H1N1, H1N2 oder H3N2 handelt. Ante-mortem-Proben sollten mit Vorsicht interpretiert werden, ein positives Ergebnis kann von Tieren stammen, die zwar Antigenkontakt hatten, ohne jedoch klinisch erkrankt zu sein. Soll eine spezielle IAV-Variante in einer Population charakterisiert werden, kann auch eine Virusisolation durchgeführt werden. Auch die Sequenzierung bestimmter Proteine, wie beispielsweise dem Hämagglutinin, ist möglich.
Die Immunhistochemie (IHC) kann ebenfalls für die Influenzadiagnose bei Schweinen genutzt werden, allerdings nur, wenn formalinfixiertes Gewebe zur Verfügung steht. Eine chemische Reaktion erzeugt ein Signal, das virales Antigen kennzeichnet und nachfolgend unter dem Mikroskop betrachtet werden kann. Ein Vorteil der IHC ist, dass das Virussignal mit den durch Influenza verursachten Lungenläsionen assoziiert ist. Allerdings ist es möglich, dass die Probenauswahl und die Formalinfixierung sowohl die Sensitivität als auch die Spezifität des Verfahrens beeinträchtigen.
Ante-mortem-Proben wie Speichelproben und Nasentupfer eignen sich für den Nachweis von IAV bei Schweinen. Speichelproben haben sich gegen die Nasentupfer durchgesetzt, da sie einfach zu gewinnen sind und eine große Tierzahl repräsentieren. Speichelproben können folgendermaßen gewonnen werden: Baumwolltücher sollten für circa 20-30 Minuten auf Schulterhöhe in den Stall gehängt werden. Wichtig ist, Kontaminationen durch Futter, Kot und anderes organisches Material zu vermeiden. Nasentupfer müssen unter Zuhilfenahme eines Tupfers aus Viskose oder Polyester mit Plastikstiel gewonnen werden. Außerdem ist ein für Viren geeignetes Transportmedium nötig, um den Tupfer vor dem Austrocknen zu schützen.
Speichelproben eignen sich weniger für neugeborene Ferkel, sind aber eine adäquate Probenart für Absatzferkel, Läufer, Mastschweine sowie ausgewachsene Schweine. Ein Nachteil von Speichelproben besteht darin, dass gewisse Hemmstoffe enthalten sein können, dies kann die RT-PCR beeinflußen. Auch geringe Virusgehalte können eine Sequenzierung oder die Virusisolation erschweren. Die Sequenzierung und die Virusisolation aus Nasentupfern ist erfolgreicher, da in diesen Proben mehr Virusmaterial enthalten ist. Vorraussetzung ist hierbei allerdings, dass eine ausreichende Probenzahl von Einzeltieren gewonnen wurde, um die betreffende Schweinepopulation während der akuten Infektionsphase repräsentieren zu können.
Die sichere Diagnose einer klinischen IAV-Infektion bei Schweinen erfordert eine Sektion und Proben von formalinfixiertem sowie frischem Lungengewebe, Trachea oder Lungenlavageflüssigkeit. Bei infizierten Lungen zeigen sich rot-violette, multifokale Verdichtungen im kranioventralen Lungenbereich. Histopathologisch fällt eine Epithelnekrose der Bronchien oder Bronchiolen auf. Erst wenn klinische Symptome, die makro- sowie mikropathologischen Läsionen und weitere diagnostische Tests (RT-PCR, IHC) übereinstimmen, kann eine gesicherte Influenzadiagnose gestellt werden (Abbildung 2).
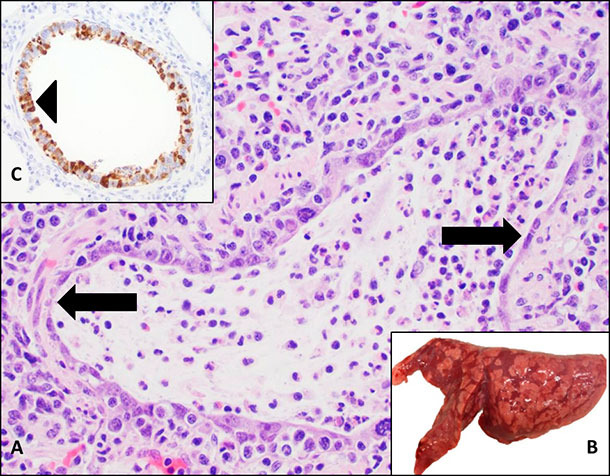
Abbildung 2.Das Influenza A-Virus ist ein wichtiger Erreger von Atemwegserkrankungen beim Schwein . A. Microscopische Läsionen bei einer Influenza A-Infektion umfassen eine Nekrose des Bronchialepithels (Pfeil) in dem sich das Virus repliziert. B. Makroskopische Läsionen zeigen sich als rot-violette Verdichtungen mit Schachbrettmuster C. Das Influenza-A Virus kann mittels Immunhistochemie (IHC) nachgewiesen werden. Es zeigt sich als braunes Signal in nekrotischen Lungenarealen (Pfeilspitze).

Mittels Serumprobe können IAV-Antikörper detektiert werden. Mit dem Blocking-ELISA, der gegen das konservierte Influenza-Nukleoprotein gerichtet ist, können Virusexposition, eine Impfung oder maternale Antikörper bei neugeborenen Ferkeln oder Absetzern nachgewiesen werden. Allerdings ist der IAV-ELISA nicht dazu geeignet, Schutz gegen eine Infektion zu bestätigen. Dazu können unterstützend funktionelle Antikörperassays wie der Hämagglutinininhibitonstest (HI) oder der Serumneutralisationstest (SVN) herangezogen werden. Diese können bei Verwendung von geeigneten Antiseren oder Virusantigen eine Crossprotektion bestätigen. Der Einsatz von Impfstoffen und aktive endemische Infektionen können jedoch in vielen Gegenden die Effizienz serologischer Testverfahren einschränken. Die Interpretation von serologischen Ergebnissen im Kontext zu herdenspezifischen Merkmalen und Symptomen erfordern ein hohes Maß an Gründlichkeit.
Zusammenfassend kann gesagt werden, dass für eine erfolgreiche Diagnosestellung eine gerichtete diagnostische Fragestellung und die gezielte Auswahl geeigneter Testverfahren notwendig ist. Im Zweifel sollte ein Tierarzt und/oder ein diagnostisches Labor zu Rate gezogen werden, um bestmöglich von den verfügbaren Testverfahren zu profitieren.


