Um klinische Probleme bei Tieren jeglicher Art zu bekämpfen, ist die Erstellung einer präzisen Krankheitsdiagnose unerlässlich. Die klinische Untersuchung des/der Patienten bildet dabei stets die Grundlage für das weitere diagnostische Vorgehen.
Plötzliche Krankheitsausbrüche stellen sowohl für Landwirte als auch für Tierärzte eine erhebliche Herausforderung dar, da sie die Ursachen des Problems schnell erkennen und wirksam bekämpfen müssen, um den Normalzustand wiederherzustellen. In solchen Situationen übernimmt der Schweinetierarzt die Rolle eines Ermittlers, der in einem komplexen Szenario eine Vielzahl von Faktoren analysieren muss, die zur Krankheitsursache beitragen können. Dies umfasst Umweltbedingungen, Ernährungsfaktoren, Biosicherheitsmaßnahmen, epidemiologische Aspekte, das Vorhandensein mehrerer Krankheitserreger sowie die komplexen Wechselwirkungen zwischen Mensch und Schwein.

Krankheiten, die eine gesamte Population betreffen, sind meist infektiösen oder ernährungsbedingten Ursprungs (Toxizitäten oder Mangelerscheinungen). Der erste diagnostische Ansatz umfasst daher stets eine gründliche klinische und epidemiologische Untersuchung durch den Tierarzt. Wenn das klinische Bild eine hohe Sterblichkeit oder schwer erkrankte Schweine zeigt, sollte die Nekropsie einiger Tiere (die als repräsentativ für den Krankheitszustand betrachtet werden) Hinweise auf die Ursache liefern oder zumindest den Ausschluss bestimmter Ätiologien ermöglichen.
Diese Nekropsie sollte ordnungsgemäß, systematisch und vollständig durchgeführt werden.
Vorhandene Läsionen liefern in den meisten Fällen keine eindeutige Ursache, ermöglichen aber eine Orientierung und die Eingrenzung der differenzialdiagnostischen Liste
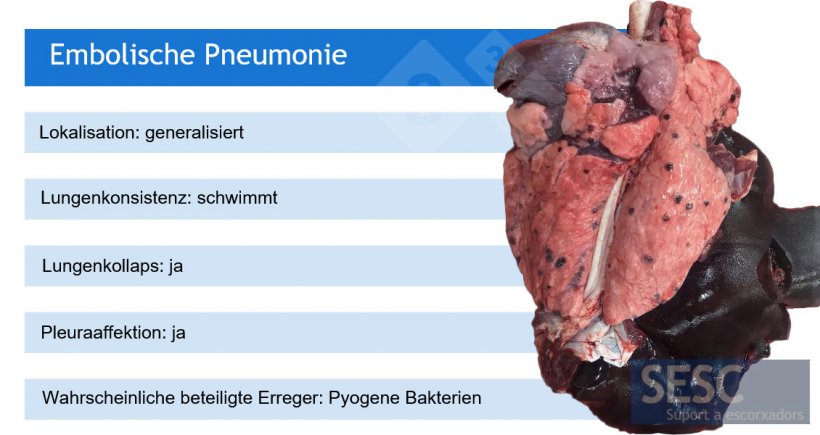
So weisen beispielsweise makroskopische Pneumonie-Muster auf eine Reihe von ätiologischen Möglichkeiten hin, auch wenn in einigen Fällen zusätzliche (Labor-)Tests erforderlich sind.
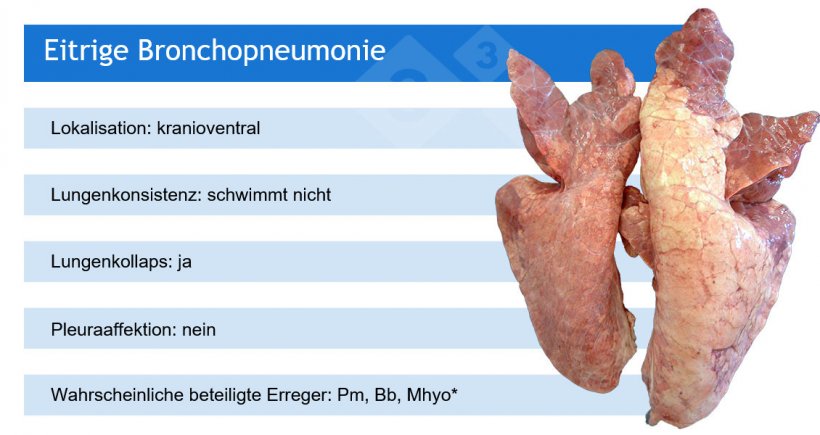
Pm: Pasteurella multocida; Bb: Bordetella bronchiseptica; Mhyo: Mycoplasma hyopneumoniae.
*Mhyo ist in der Regel an eitrigen Bronchopneumonien als auslösender Erreger beteiligt (und verursacht zunächst eine broncho-interstitielle Pneumonie).
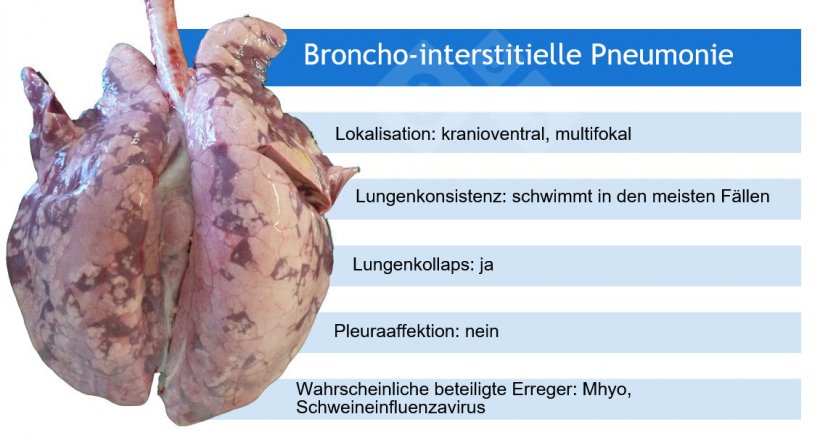
Mhyo: Mycoplasma hyopneumoniae
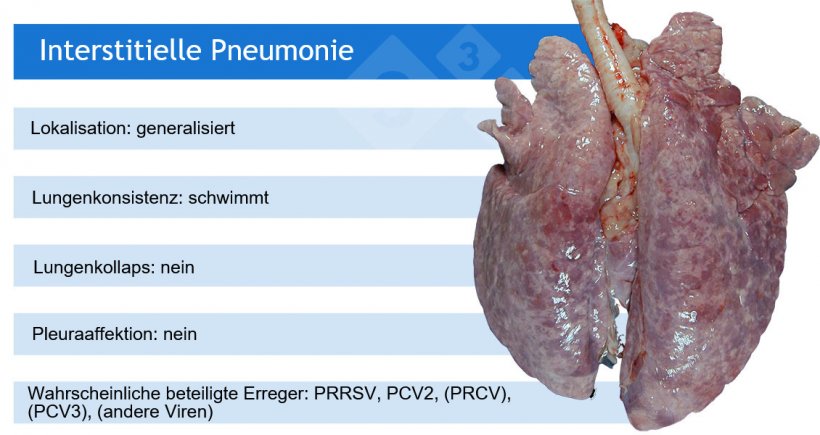
PRRSV: Virus des porzinen reproduktiven und respiratorischen Syndroms; PCV2: porzines Circovirus 2; PRCV: porzines respiratorisches Coronavirus; PCV3: porzines Circovirus 3.
PRCV, PCV3 und andere Viren wie Adenoviren, das Aujeszky-Virus und weitere verursachen in der Regel leichte interstitielle Pneumonien.
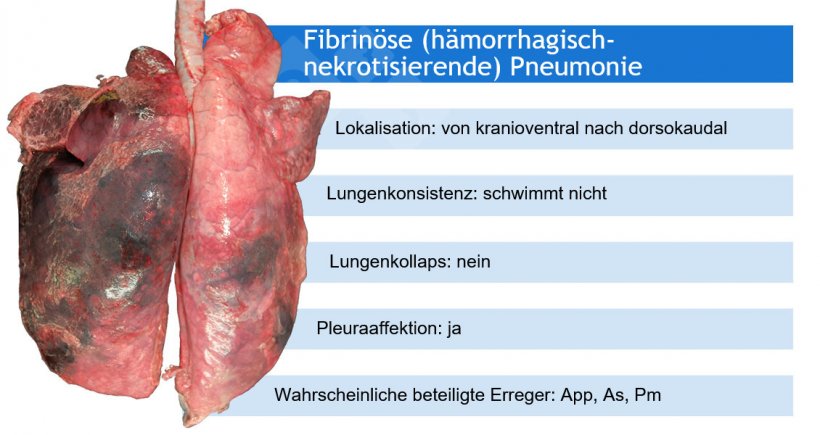
App: Actinobacillus pleuropneumoniae; As: Actinobacillus suis; Pm: Pasteurella multocida
Laboranalysen: Es ist nicht alles Gold, was glänzt!
Verschiedene analytische Ansätze helfen bei der Identifizierung potenzieller Krankheitserreger (Viren, Bakterien, Parasiten, Pilze) oder Toxine, die an einem klinischen Problem beteiligt sind. Am häufigsten werden heutzutage molekularbiologische Tests wie die Polymerase-Kettenreaktion (PCR) und ihre Varianten (qualitativ, quantitativ, für DNA oder RNA) eingesetzt. Der große Vorteil dieser Technik ist ihre Sensitivität (sie kann minimale Mengen des Erregergenoms oder Gene, die für ein Toxin kodieren, nachweisen), aber dies ist auch ihr Nachteil, denn der bloße Nachweis eines Erregers oder Toxins in einem endemischen Szenario reicht nicht aus, um eine eindeutige ätiologische Diagnose zu stellen.
Andere labortechnische Verfahren wie die Bakterienisolierung (einschließlich Antibiogramm) sind äußerst nützlich, da sie eine ätiologische Diagnose ermöglichen und einen möglichen erfolgreichen Behandlungsansatz bieten. Antikörper-Nachweisverfahren sind wiederum hervorragende Überwachungsinstrumente, bieten aber nur geringe Diagnosemöglichkeiten, da das Vorhandensein solcher Antikörper vom Impf- und/oder Infektionsstatus sowie von der mütterlichen Immunität abhängt.
Histopathologie: ein wertvolles Instrument zur Gewährleistung der Kohärenz bei der diagnostischen Untersuchung
Neben den Labortests, die speziell auf die Bestimmung von Krankheitserregern oder Toxinen ausgerichtet sind, kann die Histopathologie einen soliden Rahmen für die Identifizierung der tatsächlichen Kausalität eines klinischen Problems bieten. Mit anderen Worten: Der Nachweis eines bestimmten Erregers oder Toxins muss mit den klinischen, epidemiologischen und makroskopischen Beobachtungen übereinstimmen, und histopathologische Analysen können diese Übereinstimmung definitiv bestätigen.
Ein gutes Beispiel für die Nützlichkeit der mikroskopischen Bewertung wäre der Nachweis eines Virus mittels PCR bei einem Atemwegsproblem, bei dem die typischen histologischen Läsionen, die durch diesen Erreger verursacht werden, in der Lunge nicht vorhanden sind (vorausgesetzt, das Schwein oder die Gruppe von Schweinen ist repräsentativ für den beobachteten Krankheitszustand). Ein solches Szenario sollte Anlass sein, die Verdachtsdiagnose zu überdenken und weiter zu untersuchen.
Der Schweinetierarzt sollte die Histopathologie als ein sehr wertvolles Instrument betrachten, das mindestens ebenso wichtig ist wie PCRs, Bakterienisolierung oder Antikörpernachweisverfahren. Die mikroskopischen Analysen ermöglichen morphologische Diagnosen, die die klinischen, epidemiologischen oder sonstigen Laborergebnisse bestätigen oder widerlegen und somit zur Bestimmung der wahrscheinlichen Ätiopathogenese des klinischen Problems beitragen. Diese umfassenden Informationen sind wichtig, da sie eine Art Vorhersage darüber bieten, wie die zur Bekämpfung der Krankheit ergriffenen Kontroll- und Präventionsmaßnahmen wirken oder nicht wirken könnten.
Die Entnahme von Proben für die Histopathologie (und für andere Labortests) ist relativ einfach, erfordert jedoch bestimmte Kenntnisse der Krankheitspathogenese sowie einige technische Fähigkeiten:
- Die Proben müssen von frischen Schlachtkörpern entnommen werden (idealerweise von kürzlich verendeten oder notgetöteten Schweinen).
- Die Gewebe müssen sofort durch Eintauchen in 10%iges gepuffertes Formalin fixiert werden.
- Die Einreichung von gekühlten Proben für histopathologische Analysen wird nicht empfohlen, da ein gewisser Grad an Autolyse auftritt.
- Außerdem führt das Einfrieren von Proben zu zahlreichen Artefakten, die die mikroskopische Interpretation erschweren.
- Die Gewebeprobe muss relativ klein sein (oder zumindest dünn, um die Fixierung zu begünstigen).
- Die Proben sollten sowohl stark betroffene Bereiche als auch Stücke von vermutlich normalem Gewebe enthalten (Abb. 1).
- Bei Darmproben ist es wichtig, den Darm in Längsrichtung zu öffnen, um sicherzustellen, dass das Formalin in direkten Kontakt mit der Darmschleimhaut kommt.
- Im Gegensatz dazu wird bei großen Organen wie dem Gehirn empfohlen, dieses entweder ganz oder zur Hälfte zu fixieren, damit sichergestellt ist, dass die Gehirntopographie während der Fixierung erhalten bleibt, sodass der Pathologe später den richtigen Abschnitt auswählen kann, um die wahrscheinlichste Diagnose zu stellen.
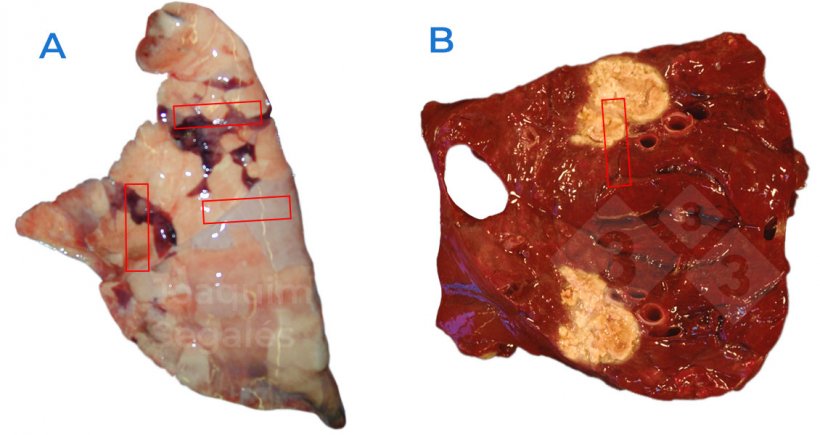
Abb. 1: A. Es wird empfohlen, eine allgemeine Probenahme in der Lunge vorzunehmen, die sowohl normale als auch geschädigte Bereiche umfasst. B. Bei fokalen Läsionen sollten Proben auch aus normalen Bereichen entnommen werden, nicht nur aus geschädigten.
Wichtig ist, dass neben der einfachen histopathologischen Analyse (auf der Grundlage der Hämatoxylin- und Eosinfärbung, Abb. 2) auch andere pathologische Zusatzuntersuchungen bei der Suche nach ätiologischen Erregern hilfreich sein können.
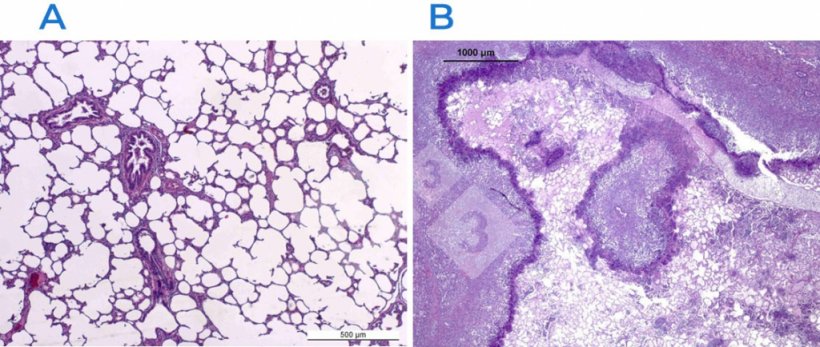
Abb. 2: Hämatoxylin- und Eosinfärbung in einer normalen (A) und einer geschädigten (B) Lunge. Die Lunge in B ist von einer fibrinös-nekrotisierenden Pleuropneumonie betroffen, die durch Actinobacillus pleuropneumoniae verursacht wurde.
Die am häufigsten verwendeten Verfahren sind die Immunhistochemie (Abb. 3) und die In-situ-Hybridisierung (Abb. 4), die den Nachweis von Krankheitserregern am Ort des Geschehens ermöglichen und ihre Rolle im klinischen und pathologischen Kontext belegen. Daneben gibt es weitere Techniken (histochemische Färbungen), die zwar nicht ausreichen, um eine bestimmte Ätiologie festzustellen, aber Hinweise auf die Ursache geben können (z. B. Groccot-Färbung zum Nachweis von Pilzen oder Gram-Färbung zum Nachweis grampositiver oder -negativer Bakterien).
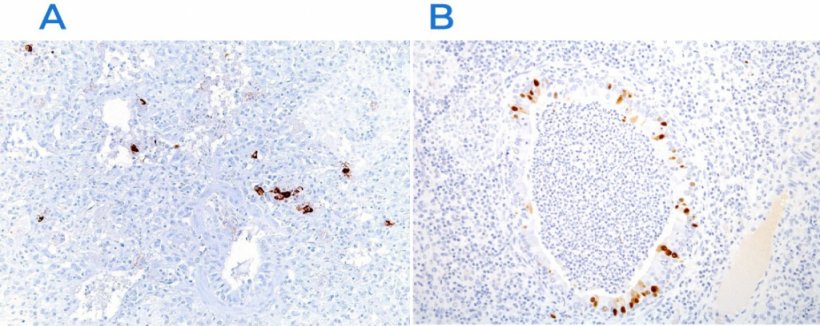
Abb. 3: Immunhistochemie zum Nachweis des Virus des porzinen reproduktiven und respiratorischen Syndroms (PRRSV) (A) und des Schweineinfluenzavirus (B). In den geschädigten Bereichen sind virale Antigene (braune Färbung) vorhanden.
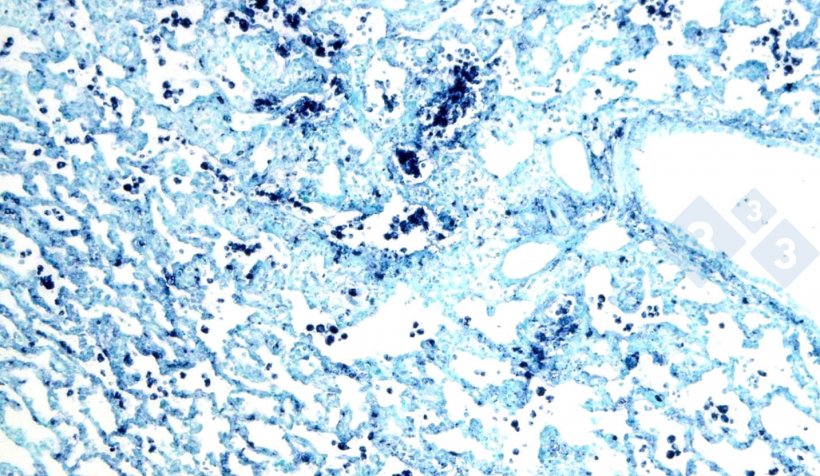
Abb. 4: In-situ-Hybridisierung zum Nachweis des porzinen Circovirus 2 (PCV-2) in einer von interstitieller Pneumonie betroffenen Lunge.
Zusammenfassend lässt sich sagen, dass der Schweinetierarzt neben seinen eigenen klinischen, epidemiologischen und makroskopischen Beobachtungen eine Vielzahl von Analysemöglichkeiten hat, bei denen die Histopathologie eine wichtige Rolle spielen kann. Eine effektive Kommunikation zwischen Medizinern und Pathologen verbessert die diagnostischen Möglichkeiten und führt zu einer schnelleren und effizienteren Lösung klinischer Probleme.




