Vorstellung des Betriebes
Der Fall ereignete sich in der Ferkelaufzucht. Diese findet an einem gesonderten Standort statt und gehört zu einem Sauenbetrieb mit Gruppenabferkelungssystem, bei dem alle drei Wochen 85-90 Würfe (900-1.000 Ferkel/Gruppe) abgesetzt werden. Die Ferkel werden mit einem Durchschnittsalter von 26-28 Tagen und einem Durchschnittsgewicht von 7,4-7,6 kg angeliefert.


Foto 1. Ferkelaufzuchtbetrieb (Außenansicht).
Der Aufzuchtbetrieb wird kontinuierlich bewirtschaftet (alle drei Wochen kommt eine neue Gruppe an Ferkeln), sodass immer mindestens zwei verschiedene Gruppen anwesend sind. Das Gebäude besteht aus drei nebeneinanderliegenden Abteilen, die nach dem Rein-Raus-Prinzip belegt werden. Etwa 29 Ferkel werden pro Bucht gehalten. Diese verfügen über einen Beton-/Kunststoffspaltenboden, über eine ad libitum Fütterung an Längströgen und über eine angemessene Anzahl an Nippeltränken. Die Lüftung ist halbnatürlich mit Ventilatoren und einer Warmluftheizung. Die Hygiene- und Managementstandards können als mittel bis hoch angesehen werden.

Foto 2. Ferkelaufzuchtbetrieb (Innenansicht).
Der Gesundheitsstatus ist hoch (negativ auf PRRS, Aujeszky, APP und Rhinitis atrophicans). Die Ferkel werden in den Abferkelbuchten im Sauenbetrieb gegen Mycoplasma hyopneumoniae geimpft und erhalten für gewöhnlich keine Behandlung, wenn sie im Aufzuchtbetrieb ankommen. In der Vergangenheit traten vereinzelt Probleme mit Meningitis und plötzlichen Todesfällen aufgrund von Streptococcus suis auf. Diese konnten erfolgreich mit Amoxicillin im Trinkwasser (manchmal im Futter) behandelt werden.
Bis zum November 2011 waren die Leistungsparameter in der Ferkelaufzucht gut. Die Verluste (tote und euthanasierte Ferkel) lagen unter 4%, die Tageszunahmen waren höher als 450g und die Futterverwertung lag bei 1,6-1,7.
Auftreten der Symptomatik, Labortests und Diagnose
Ende November 2011 bemerkte der Besitzer des Betriebes plötzlich einen Anstieg bei den Ferkelverlusten. Das betraf vor allem die größten Ferkel in der älteren Gruppe, allerdings waren nach Angaben des Landwirtes keine genauen Symptome erkennbar, außer dass jeden Tag tote Ferkel im Stall lagen.
Beim ersten Bestandsbesuch waren die Tiere lebhaft, sahen gut aus und zeigten eine regelmäßige Futteraufnahme. Es konnten keine Hinweise auf eine Respirations- und Verdauungskrankheit beobachtet werden. Die auf dem Hof durchgeführte Sektion zweier Tiere ließ keinen eindeutigen Schluss für eine Diagnose zu, da pathognomonische oder hinweisende Läsionen fehlten. Von diesen beiden Ferkeln wurden Proben an ein Labor geschickt, um das Vorkommen von Streptococcus oder anderen Bakterien, die zu plötzlichen Todesfällen führen können, wie z.B. E. coli K88 (F4), abzuklären. Mithilfe von PCR und serologischen Untersuchungen konnte bestätigt werden, dass der Standort immer noch PRRS- und Aujeszky-negativ war. Eine metaphylaktische Behandlung mit Amoxicillin (20 mg/kg Lebendgewicht) über das Trinkwasser blieb ohne Erfolg. In den folgenden Tagen und Wochen wurden die Verluste nicht nur gruppenweise, sondern auch buchtweise erfasst. Dabei zeigten bestimmte Buchten eine Mortalitätsrate von bis zu 50%!
Einige Tage später konnten während der Sektion von weiteren Schweinen Veränderungen (Nekrosen) am Myokard dargestellt werden, die hinweisend auf das Enzephalomyokarditis-Virus (EMCV) sein könnten.
Deshalb wurden weitere Proben (tote Ferkel und/oder Organe) zum Hauptsitz des Instituts für zootechnische Untersuchungen der Lombardei und Emilia-Romagna (IZSLER) geschickt. Dort wurde das Vorhandensein von EMCV durch PCR und Zellkultur bestätigt. Das pathologische Institut der Universität Parma führte histologische Untersuchungen an Gehirn- und Herzschnitten von drei weiteren Ferkeln durch. Kurz danach wurden sofort Kot- und Urinproben von Ferkeln aus verschiedenen Buchten genommen, um zu bestimmen, ob die Tiere das Virus ausscheiden.
|
 |
|
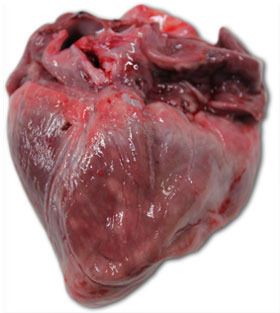
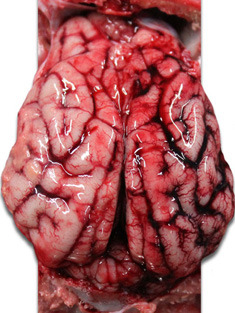
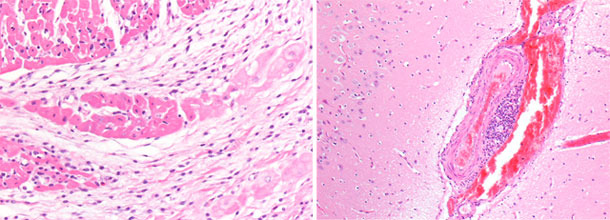
| Foto 3. Herz eines Ferkels, welches im Alter von 40 Tagen verendete. Zu erkennen ist eine deutliche Vergrößerung des rechten Ventrikels mit multifokalen Nekrosen (weiße Flecken) und gallertartiger Atrophie des epikardialen Fettgewebes. | Foto 4. Gehirn eines Ferkels mit Stauung der Venen der rechten Hirnhälfte. |
|
Foto 5. Gehirn eines Ferkels. Verdickung und Stauung der Venen der rechten Hirnhälfte. |
Foto 6. Myokardium, rechter Ventrikel. Basophile, fokale Nekrose des Myokardiums mit Mikrovakuolisation. |
Zusammenfassung der Ergebnisse
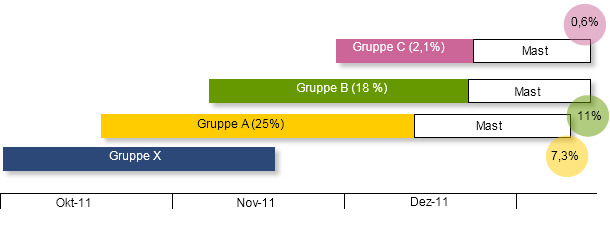
Trotz aller Bemühen, das Ausbreiten der Infektion zu begrenzen, stiegen die Verluste (besonders die plötzlichen Todesfälle der größten Ferkel) in der Gruppe A bis auf 25% an. Diese Gruppe hatte innerhalb der ersten zwei Wochen nach dem Umstallen in die Mastanlagen immer noch eine Verlustrate von 7%. Die Verluste in der Gruppe B erreichten ungefähr gleiche Werte (18%), als die Gruppe C am 01. Dezember in die Ferkelaufzucht eingestallt wurde. Die Zeitabfolge der einzelnen Gruppen in der Ferkelaufzucht ist in der folgenden Grafik dargestellt.
Das pathologische Institut der Universität Parma bestätigte zum einen das diffuse Auftreten von Petechien verbunden mit Verfärbungen des Myokardiums, was auf eine schwerwiegende Form einer Myokarditis hindeutete, und zum anderen eine diffuse Kongestion (Blutandrang) der Meningen.
Die zehn Kot- und drei Urinproben von Gruppe A und B, die an das IZSLER nach Bescia geschickt wurden, waren alle positiv auf EMCV.
Diskussion
Die virologischen und histopathologischen Untersuchungen bestätigten, dass dieser schwerwiegende Fall von plötzlichen Todesfällen, die besonders in den Gruppen A und B beobachtet wurden, auf eine Infektion mit dem Enzephalomyokarditis-Virus zurückzuführen ist. Nach der wissenschaftlichen Fachliteratur sind Ratten und Mäuse Träger und Überträger dieser Infektion. Obwohl dazu keine Daten vorliegen, könnte eine einzelne Gruppe von Ratten/Mäusen dieses Problem am Anfang ausgelöst haben. Auch wenn die Schädlingsbekämpfung sehr gründlich durchgeführt wurde und keine Hinweise auf das Vorhandensein vermehrter Nagetiere vorlag. Es wurde kein Nagerkot beobachtet und erst nach einer intensiven Suche konnten einige kleine Mausspuren entdeckt werden. Somit muss es einen Zeitraum (einen sicherlich kurzen) gegeben haben, in dem die Schweine als Überträger/Vermehrungsort für die Infektion fungierten. Dieser Zeitraum umfasst wahrscheinlich 1-3 Tage: vom Tag 0 (Zeitpunkt der Infektion) bis zum Tod des Tieres. Diese Hypothese konnte durch den Nachweis von EMCV im Kot und Urin und die Häufung von Todesfällen in bestimmten Buchten bestätigt werden.
Schlussfolgerung
Aufgrund der hohen Umgebungskontamination und der hohen Mortalität Mitte Dezember (Gruppe B erreichte nach etwas mehr als einem Monat nach der Einstallung 18%) wurde entschieden, den Aufzuchtbetrieb vollständig zu leeren und alle Ferkel aus den Gruppen B und C in einer externen Mastanlage unterzubringen (3. Standort). Nach der Bestandsräumung wurden die Aufzuchtabteile gründlich mit Schäummittel eingeweicht, mit Heißwasser-Hochdruckreinigern gereinigt und anschließend desinfiziert. Obwohl die Schädlingsbekämpfung bereits gut war, wurden alle Bekämpfungsmaßnahmen gegen Nager überprüft und verstärkt. Als weitere Sicherheitsmaßnahme wurden zusätzlich alle Räume einer thermischen Vernebelung unterzogen. Der Standort blieb für eine Woche vollständig leer. Am 29. Dezember wurde eine neue Gruppe eingestallt. Weder diese noch die folgenden Gruppen zeigten eine vergleichbare Symptomatik mit EMCV.
Epidemiologische Anmerkungen
Das Auftreten des Enzephalomyokarditis-Virus (EMCV) unter Haus- und Wildschweinen in verschiedenen Europäischen Ländern wurde in mehreren Fachartikeln beschrieben und diskutiert. Nach dem Review von Maurice H. et al (2005) wurden die meisten klinischen EMCV Ausbrüche in Belgien (320), gefolgt von Italien (110), Griechenland (15) und Zypern (6) gemeldet. Die Ausbrüche traten gehäuft in endemischen Gebieten auf und dabei vor allem während der Herbst- und Wintermonate. Die innerbetriebliche Seroprävalenz bei klinisch auffälligen Schweinebetrieben variierte deutlich zwischen den Beständen (2-87%), mit dem Alter (0-84%) und zwischen den Ländern. Daten von Betrieben ohne klinische Anzeichen zeigten, dass eine subklinische Infektion mit EMCV sowohl innerhalb (Seroprävalenz 6-62%), als auch außerhalb (bis zu 17%) der endemischen Gebiete in klinisch betroffenen Ländern und auch in den nicht-klinisch betroffenen Ländern Österreich und Frankreich (3-5,4%) stattfand. Unter den Wildschweinen variierte die Seroprävalenz zwischen 0,6 und 10,8%. Eine Studie aus Belgien beobachtete eine Prävalenz der Virusinfektion von 3,3%.