Es ist bekannt, dass das von Immunsystem und neuroendokrinem System gebildete komplexe Signalnetzwerk eine entscheidende Rolle bei der Modulation von Entzündungsreaktion und Immunantwort auf umweltbedingte Gefährdungen (z.B. durch pathogene Keime, Ernährungsfaktoren, etc.) spielt, in deren Folge es zu einer systemischen Reaktion kommt.
Ziel ist die Aufrechterhaltung der Homöostase, also des dynamischen Gleichgewichts, bei dem kontinuierliche Veränderungen die optimalen Bedingungen für das Überleben schaffen. Die Multi-Sektor-Kommunikation stellt die Aufrechterhaltung der Homöostase und damit der Gesundheit sicher.

Immunsystem, endokrines System und Zentralnervensystem kommunizieren über anatomische und Neuropeptidhormon-Pfade.
Die efferenten Nerven des sympathischen Nervensystems innervieren die primären und sekundären Lymphorgane; Adrenalin und Noradrenalin aktivieren - wie sich gezeigt hat - die Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HPA-Achse) und wirken auf die β2-Adrenozeptoren der Leukozyten.
Immunzellen exprimieren Rezeptoren für viele Hormone (z.B. adrenokortikotropes Hormon [ACTH], Prolaktin [PRL], Wachstumshormon [GH], Leptin, Glukokortikoide, Östrogene und Testosteron, Neurotransmitter und Neuropeptide wie VIP, Substanz P, Norepinephrin, Somatostatin und Neuropeptid Y). In gleicher Weise besitzen endokrines und neurales Gewebe spezifische Rezeptoren für die vom Immunsystem stammenden Zytokine.
Vor diesem Hintergrund erscheint es auch klar, dass die Funktionen von Immunzellen durch neuroendokrine Hormone verändert werden können und dass Immunzellen ihrerseits die Fähigkeit besitzen, Hormone mit funktionaler neuroendokriner Reaktion zu produzieren.
Hormone und Zytokine, insbesondere die pro-inflammatorischen und regulatorischen Zytokine, sind die Hauptakteure in diesem koordinierten Konzert. Ihre Aktion bewirkt eine Stärkung der angeborenen Immunreaktion und eine Kontrolle der Entzündungreaktion mit einer Steigerung der Effizienz der Immunantwort. Tatsächlich setzt dies auch als Reaktion auf eine pathogene Attacke ein, um die Homöostase wiederherzustellen. Umgekehrt kann eine Dysregulierung dieser neuro-immunen Reaktion sowohl die Immunantwort auf Pathogene als auch die Stoffwechseleffizienz beeinträchtigen.
Hinsichtlich dieses Mechanismus aus Kontrolle und Gegenkontrolle liegen immer mehr Beweise dafür vor, dass die Mikrobiota des Darms dabei eine fundamentale Rolle spielt. Die Darmmikrobiota interagiert eng mit dem größten neuroendokrinen System des Körpers, das verschiedene Vorgänge im Organismus in Reaktion auf Stress steuert, nämlich der Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HPA-Achse). Diese Interaktion ist von zentraler Bedeutung, da verschiedenste Störungen der Mikrobiota-Darm-Gehirn-Achse mit einer Dysregulierung der HPA-Achse und des in Interkorrelation stehenden Immunsystems in Verbindung gebracht werden.
Die Aktivierung der HPA-Achse und die Sekretion von Glukokortikoiden stellen einen der wichtigsten neuroendokrinen Pfade zur Regulierung von lokalen und systemischen Entzündungen dar.
Allerdings sind auch Prolaktin und GH an der Entwicklung und Effizienz der Immunantwort beteiligt. Sie sind Signalstoffe, die die Proliferation, Differenzierung und Funktion von immunkompetenten Zellen in Reaktion auf spezifische antigene Stimuli durch eine endokrine und parakrine Aktion fördern. Tatsächlich werden beide Hormone, die mit den Hormonen der endokrinen Drüsen identisch sind, von Immunzellen synthetisiert, gespeichert und sezerniert.
Weißes Fettgewebe spielt in diesem neuro-immunen Netzwerk eine entscheidende Rolle, da es eine Verbindung zwischen Ernährungsstatus, Stoffwechsel und Energiebilanz zur Aufrechterhaltung der Homöostase des Körpers darstellt. Die vorwiegend im Fettgewebe synthetisierten Produkte sind als Adipokine bekannt, einschließlich anti- und pro-inflammatorischer Faktoren wie der klassischen Zytokine, aber auch spezifischer Hormone. Die wichtigsten Hormone Leptin und Adiponektin konnten auch als wichtige Akteure in diesem Netzwerk von endokrinem System und Immunsystem identifiziert werden.
Leptin reguliert nicht nur die Nahrungsaufnahme und den Stoffwechsel, sondern stimuliert auch die Proliferation und das Überleben der lymphoiden Vorläufer und die Entwicklung von T-Zellen im Thymus. Es kann mittels Steigerung der Produktion von IL-2 und IFN-ϒ durch T-Zellen und Makrophagen auch die TH1-Antwort verbessern.
Adiponektin weist zahlreiche Isoformen auf und ist das am stärksten exprimierte Adipokin. Dieses Hormon mit hohem Molekulargewicht wirkt vor allem als anti-inflammatorischer Regulator, und zwar über die Suppression der Differenzierung und klassischen Aktivierung von M1-Makrophagen durch Herunterregulierung der pro-inflammatorischen Zytokine, d.h. von TNF-α und IL-6, die an den Adiponektin-Rezeptoren 1 wirken. Die Isoformen mit niedrigerem Molekulargewicht scheinen eine pro-inflammatorische Rolle zu spielen, da sie die Aktivität pro-inflammatorischer Moleküle steigern (Tong et al., 2011; Gomez et al., 2011) (Abbildung 1).
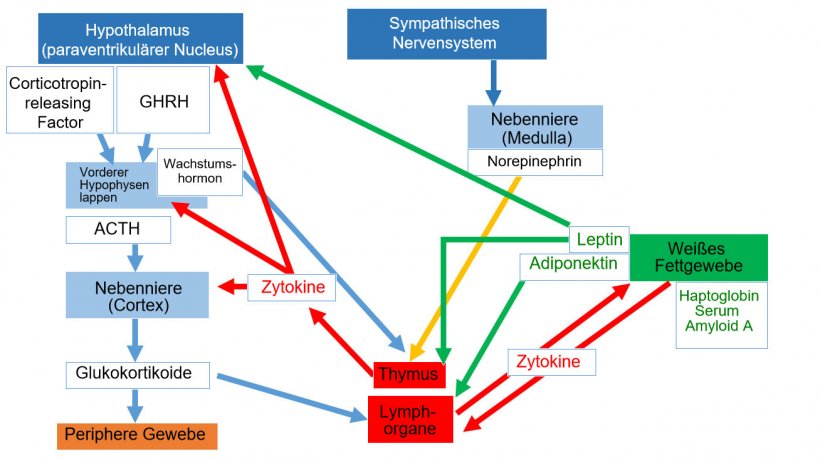
Abbildung 1.Neuroendokrin-immunes System *ACTH: Adrenocorticotropes Hormon *GHRH: Growth hormone–releasing hormone
In der intensiven Schweineproduktion können verschiedene Stressoren wie schlechte Managementpraktiken, Umweltstressoren, Ernährungsfaktoren, Absetzphase, Mischen von Gruppen, Rangkämpfe und Transport die Immunantwort hinsichtlich ihrer funktionalen Effizienz negativ beeinflussen.

Es ist bekannt, dass die ersten Lebenswochen die kritischste Phase im Leben eines Ferkels darstellen, da dies die Zeit ist, in der sich das Immunsystem und seine Effizienz schrittweise entwickeln. Während dieser neonatalen Phase können Ferkel physischen und psychischen Stressoren sowie Infektionen ausgesetzt sein, die die Effizienz der Immunantwort direkt beeinträchtigen.
Das Absetzen ist eines der belastendsten Ereignisse für die Ferkel und kann für Fehlfunktionen von Verdauungstrakt und Immunsystem prädisponieren und - insbesondere in der ersten Woche nach dem Absetzen - die Gesundheit, das Wachstum und die Nahrungsaufnahme stark beeinträchtigen.
In ähnlicher Weise sind Infektionen wichtige Faktoren, die bei lebensmittelliefernden Tieren während des Wachstums zu verringerter Leistung führen. Persistierende/subklinische Infektionen können die Wachstumsleistung beeinträchtigen, da sie sich negativ auf die Hormonachsen, den Gewebemetabolismus und die Futterverwertung auswirken.
Während einer Infektion können die Aktivierung der HPA-Achse und die Sekretion von Glukokortikoiden sowohl den Schweregrad der Infektion als auch deren Auswirkung auf den Stoffwechsel beeinflussen.
Tatsächlich hängt eine unkontrollierte Entzündung mit potenzieller Gewebeschädigung von einer komplexen Interaktion zwischen der Konzentration an Glukokortikoiden und deren peripherer Aktivität sowie großteils auch von der Konzentration und Persistenz pro-inflammatorischer Zytokine ab (TNF-a, IL-1ϐ, IL-6, IL-15).
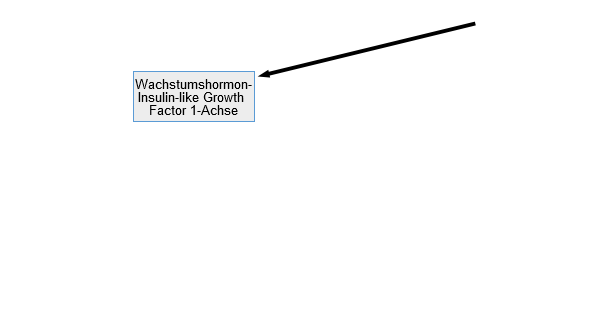
Die Aktivierung bzw. Fehlregulierung der HPA-Achse und der GH-Insulin-like growth factor 1 (IGF1)-Achse und veränderte systemische Zytokinspiegel können metabolische Veränderungen bewirken. Zu Beginn einer Infektion oder Entzündung können schwerwiegende Veränderungen im Stoffwechsel (Anstieg von GH) eine effiziente angeborene Immunantwort unterstützen (Energie wird in die Aktivierung des Immunsystems gelenkt). Danach kommt es aber zu einer Entkopplung von GH- und IGF-1-Spiegeln sowie zur Suppression der GH-Achse, zu GH-Resistenz in Leber und Skelett und zur Hemmung der IGF-1-Wirkung auf peripheres Gewebe (Soendergaard et al., 2017). Zusätzlich induzieren hohe Konzentrationen an Glukokortikoiden und pro-inflammatorischen Zytokinen (d.h. IL-1, TNF-α und IL-6) eine verringerte Nahrungsaufnahme, eine negative Energiebilanz mit Gewebekatabolismus, übermäßigem Protein- und Aminosäurenabbau sowie eine reduzierte Bioverfügbarkeit und Sekretion von Oligo-Elementen (z.B. Zn und Cu).
Abbildung 2. Negative Auswirkungen einer Entzündung auf Leistung und Wachstum.
Tabelle 1. Hauptsignale in der immun-neuroendokrinen Kommunikation
| Hormone | Glukokortikoide |
|
|
Wachstums-hormon (GH) |
|
|
| Leptin |
|
|
| Adiponektin |
|
|
| Zytokine | IL-1, TNFa, IL-6 |
|