Antikörper (Ak) oder Immunglobuline (Ig)
- werden von durch Antigene stimulierten B-Lymphozyten produziert und differenzieren zu Plasmazellen (ASC: antikörpersezernierende Zellen);
- werden in die extrazelluläre Körperflüssigkeit sezerniert;
- sind in der Lage, körperfremde Pathogene über multiple Mechanismen zu binden, anzugreifen, zu neutralisieren und zu eliminieren.

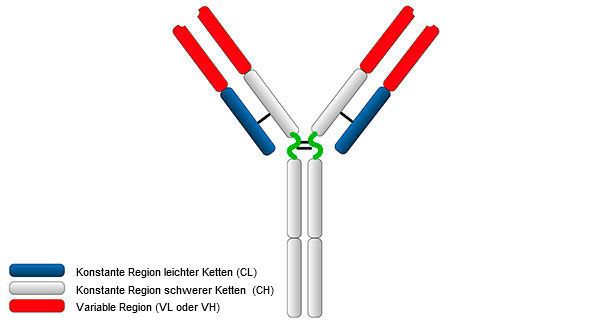
Das Immunglobulin-Monomer hat ein Molekulargewicht von 150-180 kDa und weist in etwa die Form eines "Y" auf (Abbildung 1).
Abbildung 1. Gesamtstruktur eines Immunglobulins.
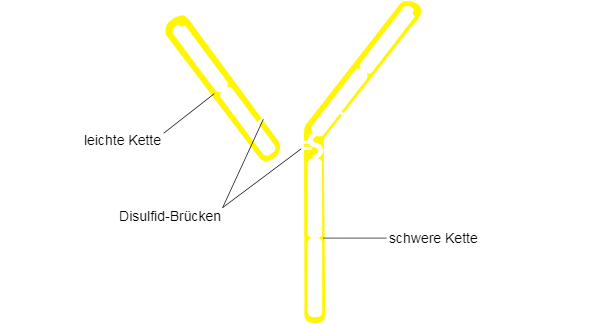
Die typische Struktur von Immunglobulinen besteht aus zwei schweren Ketten (H-Ketten, H von "heavy") und zwei leichten Ketten (L-Ketten, L von"light"), die über Disulfidbrücken verbunden sind. Beide Ketten weisen jeweils zwei Anteile auf, und zwar eine konstante Region (C) und eine variable Region (V).
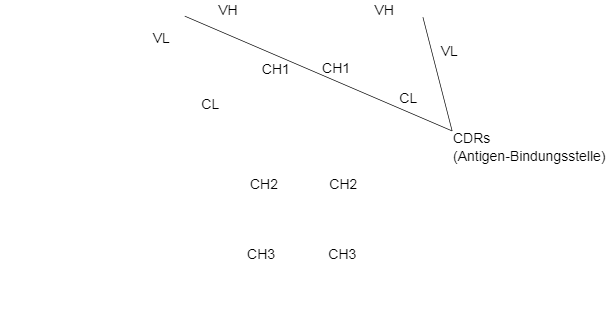
Die H- und L-Ketten haben Regionen oder Domänen, in denen sich die Proteine zu einer dreidimensionalen Struktur falten; diese werden mit VH und CH bzw. mit VL und CL bezeichnet. Schwere Ketten bestehen aus einer variablen Region (VH) und drei (bei IgG und IgA) oder vier (bei IgM und IgE) konstanten Regionen mit der Bezeichnung CH1, CH2, CH3 und CH4. Die leichten Ketten können entweder vom λ- oder κ-Typ sein und bestehen aus zwei Domänen, einer variablen Region (VL oder VK) und einer konstanten Region (CL oder CK). VH- und VL-Domänen weisen hoch variable Regionen auf, die als "Complementary Determining Regions" (CDR) bezeichnet werden und die charakteristische antigenspezifische Bindungsstelle eines jeden Antikörpers darstellen.
Zwischen CH1 und CH2 liegt eine Gelenkregion (Hinge-Region), die die Flexibilität der Ig-Moleküle ermöglicht. Bei der Spaltung der Hinge-Region durch Proteasen entstehen zwei Fab-Fragmente (enthalten die Antigenbindungsstelle) und ein Fc-Fragment (kristallisierbares Fragment), das an den Antikörperfunktionen beteiligt ist.
Die CH2- und CH3-Domänen sind die Bindungsstellen für die Fc-Rezeptoren, während die CH1-CL-Domänen das Komplementfragment C4b binden und die CH2-Domäne den Faktor C1q von Komplement bindet.
Ein Bakterium besitzt verschiedene Oberflächenepitope; bei einer Infektion werden verschiedene Antikörper gebildet und jeder Antikörper bindet an seine spezifischen Epitope auf dem Pathogen.
Die unterschiedlichen Aminosäurensequenzen der konstanten Domäne schwerer Ketten charakterisieren die verschiedenen Antikörperklassen oder Isotypen (Abbildung 2): IgD (schwere δ-Kette), IgM (schwere μ-Kette), IgG (schwere γ-Kette), IgA (schwere α-Kette) und IgE (schwere ε-Kette). IgM werden als Pentamere sezerniert und IgA als sekretorische Dimere.

Abbildung 2. Die unterschiedlichen Aminosäurensequenzen der konstanten Domäne schwerer Ketten charakterisieren die verschiedenen Antikörperklassen oder Isotypen.
Einige Ig-Subklassen mit unterschiedlichen schweren Ketten sind, hauptsächlich bei IgG- und IgA-Klassen, beschrieben worden.
Die verschiedenen Antikörper sind die Effektoren der humoralen Immunabwehr gegen Infektionserreger. Aus diesem Grund sind sie in hohen Konzentrationen im Serum und in anderen biologischen Flüssigkeiten (mukosale Sekrete wie z.B. Speichel, Muttermilch, Kolostrum, etc.) vorhanden. Die Abwehrfunktionen der Antikörper basieren auf verschiedenen Mechanismen (wird in Teil 2 dieses Artikels beschrieben).
IgG sind Immunglobuline mit einem Molekulargewicht von etwa 108 kDa. IgG-Immunglobuline liegen in großen Mengen im Serum und im extravaskulären Raum vor. Sie sind primär an der systemischen Abwehrreaktion beteiligt und bewirken die effektive Neutralisation von Viren, interagieren mit der C1-Fraktion von Komplement und aktivieren die Komplementkaskade mit Opsonisierung und Phagozytose von Pathogenen. Zudem fördern sie durch die antikörperabhängige zellvermittelte Zytotoxizität (ADCC-Reaktionen) das Abtöten von infizierten Zellen. Das Schwein verfügt über sechs IgG-Subklassen (IgG1 bis IgG6).

IgM-Monomere mit einem Molekulargewicht von etwa 108 kDa befinden sich auf der Oberfläche von B-Zellen und übernehmen die Aufgabe eines B-Zell-Rezeptors (BCR) für die Antigenerkennung durch B-Zellen. Das sezernierte IgM ist ein kreisförmiges Pentamer, dessen fünf Monomer-Untereinheiten über Disulfidbrücken und eine J-Kette miteinander verbunden sind. Diese pentamere Form hat ein Molekulargewicht von ca. 900 kDa.
IgM wird beim ersten Kontakt mit einem Antigen als erstes Immunglobulin gebildet. Es wird hauptsächlich im Zuge der primären humoralen Immunantwort sezerniert und stellt eine erste und wichtige Abwehrreaktion gegen virale und bakterielle Infektionen dar. Der Nachweis von spezifischem IgM gegen einen Erreger im Serum weist auf eine erst kürzlich erfolgte/akute Infektion hin. Diese Immunglobuline werden auch im Rahmen der sekundären Immunantwort sezerniert, jedoch in geringerer Menge. In dieser Form befinden sich die Fc-Regionen im Zentrum, mit zehn Antigenbindungsstellen in der Peripherie. IgM können mehr Moleküle des C1-Fragments für den klassischen Pfad binden und sind äußerst effizient bei der Aktivierung von Komplement für die Opsonisierung sowie bei der Neutralisation und Agglutination von Viren.
Die sogenannten natürlichen IgM-Antikörper (NA - IgM) werden von einigen Untergruppen von B-Lymphozyten gebildet, die möglicherweise an der ersten Verteidigungslinie gegen die systemische Ausbreitung von Infektionserregern beteiligt sind.
IgA ist die vorherrschende Immunglobulinklasse in Sekreten (Speichel, Schleim, Tränen, Kolostrum, Milch); sie befindet sich an mukosalen Oberflächen und verhindert die Penetration und Ansiedlung von Pathogenen.
IgE hat ein Molekulargewicht von etwa 190 kDa und ist in geringer Konzentration im Blut vorhanden. IgE-Immunglobuline sind im speziellen an der Typ-I-Hypersensibilität sowie an der Abwehrreaktion gegen Parasiten beteiligt.
IgD-Monomer spielt eine wichtige Rolle als B-Zell-Rezeptor (BCR).