Der vorliegende klinische Fall beschäftigt sich mit den langfristigen Folgen bei der Kontrolle von Actinobacillus (A.) pleuropneumoniae in einem Kombibestand in den 90er Jahren. Obwohl der Fall schon lange zurückliegt, wirft er einige Fragen in Bezug auf Bestandstruktur, Dynamik enzootischer Infektionen im Schweinebestand und Immunität gegenüber A. pleuropneumoniae auf.

Informationen zum Bestand
Anfang 1990 wurde eine Repopulierung des Sauenbestands durchgeführt, nachdem der Standort zuvor geräumt, ausgebaut und saniert wurde. Dadurch konnten anschließend 660 produzierende Sauen gehalten werden. Wöchentlich wurden ca. 300 Ferkel abgesetzt und vor Ort aufgezogen.
Weil sich die Bestandsgröße nahezu verdoppelt hat, lag ein Gebäude für Zuchttiere nun direkt neben einem Stall für Mastschweine. Abbildung 1 zeigt eine Übersicht zur Betriebsstruktur nach dem Ausbau. Der Abstand zwischen den Gebäuden betrug nicht mehr als 2 Meter.
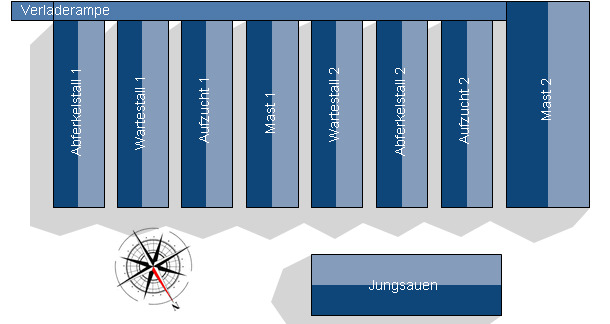
Abb. 1. Betriebsstruktur.
Alle Gebäude waren mit Vollspaltenböden ausgestattet. Die Frischluftzufuhr erfolgte über eine Überdrucklüftung mit Ventilatoren, die Abluft wurde über die Seiten abgegeben. Die Belegdichte bei den Mastschweinen entsprach den gesetzlichen Mindestvorgaben.
Die Sauenherde wurde im Wochenrhythmus bewirtschaftet. Die Abferkelabteile wurden nach dem Absetzen gereinigt und desinfiziert. Die Leerzeit zwischen den Belegungen betrug nicht mehr als 24 Stunden.
Die Repopulierung erfolgte mit Jungsauen, die positiv gegenüber Mycoplasma hyopneumoniae aber frei von allen anderen zu der Zeit bedeutenden Erkrankungen waren (PRRS, Dysenterie, Rhinitis athrophicans, Räude). Erkrankungen mit A. pleuropneumoniae wurden beim Jungsauenvermehrer weder klinisch noch pathologisch beobachtet, allerdings wurde keine ätiologische Freiheit garantiert.
Die Ferkel erhielten zu der Zeit keine Impfungen.
Krankheitsausbruch – Phase I
Für die ersten vier Jahre kann der Gesundheits- und Produktionsstatus als gut bewertet werden. Es traten nur weniger Gesundheitsprobleme in Form von E. coli-Durchfällen nach dem Absetzen auf. Zur Behandlung wurde Zinkoxid (2500 ppm) in den Futtermischungen für die ersten zwei Wochen nach dem Absetzen eingesetzt.
Ende 1995 kam es zu einem akuten Ausbruch von Atemwegsproblemen im gesamten Bestand. Es begann mit Husten bei den Mastschweinen im Maststall 2, außerdem zeigten die Tiere Teilnahmslosigkeit und Inappetenz. Diese Symptome traten schnell auch bei den Ferkeln und dann bei den adulten Schweinen auf.
Die Verdachtsdiagnose lautete Influenza. Es wurde keine Bestandsbehandlung durchgeführt, nur die jüngsten Absetzgruppen wurden für eine kurze Zeit über das Trinkwasser mit Oxytetrazyklin als Vorsichtsmaßnahme behandelt.
Bei zwei sezierten Tieren wurde der Influenza-A-Stamm H1195852 gefunden. In Blutproben, die von Läuferschweinen bei Krankheitsausbruch und drei Wochen später genommen wurden, konnte ein Titeranstieg bei den Antikörpern vor allem gegenüber Stamm H1195852 beobachtet werden. Allerdings bestanden auch einige Kreuzreaktionen gegenüber H1N1 und H3N2-Stämmen (siehe Tabelle 1).
Tabelle 1. Reziproke HAH-Antikörpertiter bei Sauen und Jungsauen*
| H1N1 | H3N2 | H1195852 | ||||
| Sauen-ID | akut | 3 Wochen später | akut | 3 Wochen später | akut | 3 Wochen später |
| 107 | 0 | 40 | 40 | 40 | 0 | 640 |
| 153 | 0 | 20 | 20 | 40 | 0 | 1280 |
| 162 | 0 | 0 | 0 | 40 | 0 | 640 |
| 201 | 0 | 10 | 20 | 40 | 0 | 640 |
| 279 | 0 | 20 | 40 | 80 | 0 | 2560 |
| 311 | 0 | 0 | 80 | 160 | 0 | 2560 |
| 432 | 0 | 0 | 10 | 40 | 0 | 1280 |
| 449 | 20 | 80 | 10 | 0 | 40 | 2560 |
| 500 | 0 | 10 | 20 | 20 | 0 | 640 |
| 561 | 10 | 10 | 0 | 20 | 0 | 320 |
| 641* | 0 | 0 | 0 | 10 | 20 | 640 |
| 645* | 0 | 10 | 0 | 40 | 10 | 1280 |
| 652* | 10 | 0 | 0 | 0 | 40 | 640 |
Jede betroffene Gruppe erholte sich nach etwa 5-7 Tagen, gleichzeitig stieg auch wieder die Fresslust. Allerdings hatte der Einbruch Auswirkungen auf die Wachstumsraten. Außerdem wurde bei den Sauen, die eine oder zwei Wochen vor dem Ausbruch besamt wurden, ein Anstieg der Umrauschquote von 10% beobachtet (regelmäßig und unregelmäßig). Es traten keine vermehrten Verluste auf (die jährliche Mortalitätsrate vom Absetzen bis zur Schlachtung lag bei 3,5%).
Die Mastschweine erreichten aufgrund der schlechteren Zuwachsraten erst später das Marktgewicht, wodurch der Abverkauf der Schweine stockte und somit die Bestandsdichte stieg.
Krankheitsausbruch – Phase II
Etwa drei Wochen nachdem die ersten Hustensymptome im Maststall 2 auftraten (und die sich schnell wieder gelegt hatten), meldete der Betrieb 22 tote Schweine in zwei Wochengruppen an einem Morgen.
21 Tierkörper zeigten vergleichbare pathologische Veränderungen. Bei allen Tieren trat schaumiges Blut an der Rüsselscheibe aus. Außerdem war das Maul geöffnet und im Thorax und ventralem Abdomen war eine deutliche Hyperämie sichtbar. Alle Schweine waren in guter Kondition und etwa 15 oder 16 Wochen alt.
Die Sektionen ergaben ein typisches Bild einer akuten Aktinobacillus-Pleuropneumonie (APP) bei 21 Schweinen (Abb. 2-5).
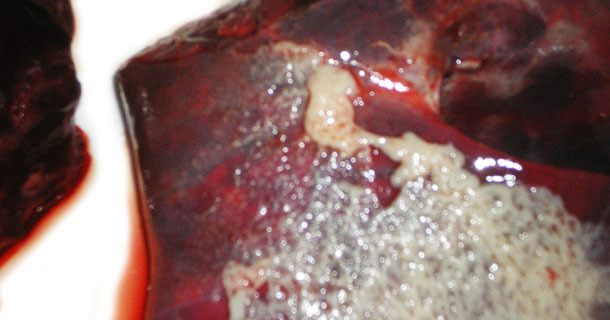
Abb. 2. Lunge mit akuter APP und fibrinöser Pleuritis.

Abb. 3. Hämorrhagische Läsionen im Lungenparenchym.
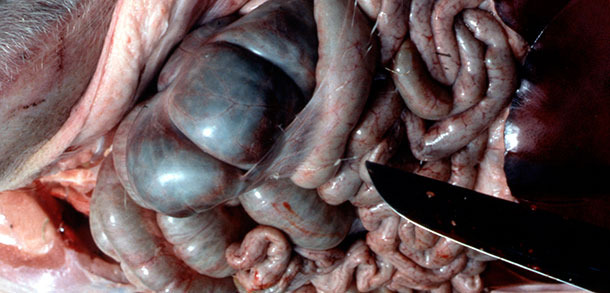
Abb. 4. Fibrinfäden in der Bauchhöhle bei akuter APP.
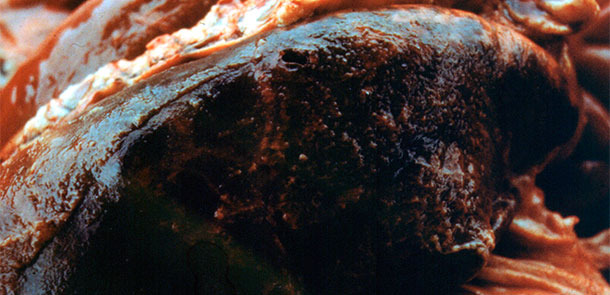
Abb. 5. Hämorrhagische Pneumonie und akute Pleuritis.
Das andere Schwein hatte eine Darmdrehung. Die Buchtengenossen in den betroffenen Abteilen waren am Husten, einige hatten rektale Temperaturen von über 42°C und waren teilnahmslos und abgeschlagen (Abb. 6). Etwa 20 Tiere zeigten eine hochgradige Dyspnoe.

Abb. 6. Typische Schweine mit akuter APP und Dyspnoe.
Laboruntersuchungen bestätigten anschließend A. pleuropneumoniae Typ 8 in Reinkultur bei acht beprobten Schweinen.
Stark betroffene Schweine erhielten eine antibiotische Behandlung mit Ceftiofur per Injektion, zusätzlich wurden die beiden betroffenen Abteile mit Amoxicillin (20mg/kg/Tag) für fünf Tage über das Trinkwasser behandelt. Die Tiergruppen sprachen zunächst gut auf die Behandlung an.
Allerdings zeigten die folgenden Wochengruppen eine vergleichbare Klinik, sodass eine sofortige Behandlung notwendig war. Deshalb wurde die Einmischung von Chlortetrazyklin in die Futterrationen für die Mastschweine eingeführt und die Behandlung zwei Wochen vor der Schlachtung wieder abgesetzt. Jeder der akuten APP Ausbrüche trat in beiden Mastställen immer um die 14.-16. Lebenswoche auf.
Krankheitsentwicklung
Innerhalb von zwei Monaten nach dem APP-Ausbruch sanken die Schlachtgewichte um 5kg/Schwein. Dazu kamen Rückmeldungen über viele Brustfellverwachsungen vom Schlachthof. Ein Schlachthofcheck bestätigte das Auftreten von Pleuritiden bei 75% und das Vorkommen chronischer APP-Läsionen bei 50% der Schweine (Abb. 7 und 8).
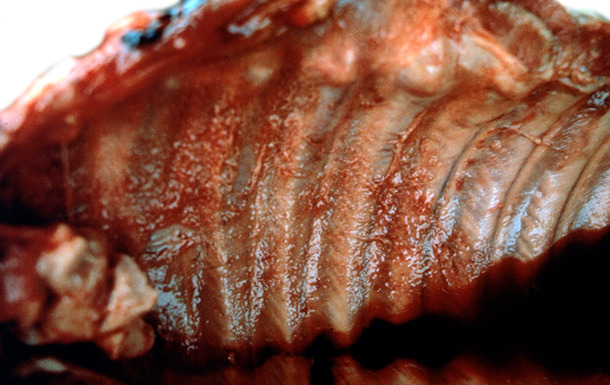
Abb. 7. Hgr. Brustfellentzündungen können den Schlachtprozess stören.
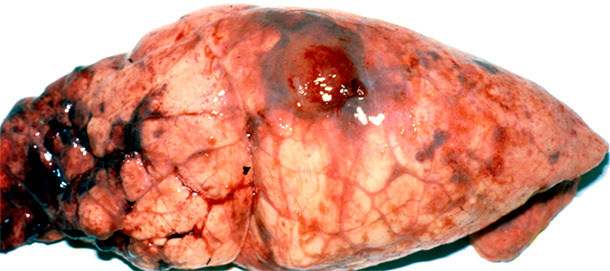
Abb. 8. Chronische APP-Läsionen im Hauptlappen mit fokaler Pleuritis.
Einige Monate lang traten keine akuten Krankheitssymptome aus, obwohl gelegentlich Verluste mit chronischen APP-Veränderungen vorkamen. Die Schweine brauchten etwa 10-14 Tage länger, bis sie das Schlachtgewicht erreicht hatten, was unweigerlich zu einer erhöhten Bestandsdichte führte. Deshalb wurde ein Strohstall für die Unterbringung von Mastschweinen gepachtet, wodurch eine leichte Entlastung erzielt werden konnte.
Alle acht Wochen wurden Jungsauen für die Remontierung geliefert. Kurz nach der Ankunft traten Symptome einer Atemwegserkrankung und gelegentlich Todesfälle auf. 15% der Jungsauen kamen nicht in die Rausche. Eine Einstallbehandlung für vier Wochen nach Ankunft reduzierte zwar die Symptome, löste das Problem aber nicht vollständig.
Anfang 1996 trat APP chronisch und enzootisch bei den Schweinen in der Vormast auf. In periodischen Schüben flackerte immer wieder die akute Verlaufsform auf. Außerdem konnten pathologische Veränderungen weiterhin am Schlachtband beobachtet werden (Brustfellentzündungen bei über 50% der Schweine). Die Verlustrate vom Absetzen bis zur Schlachtung betrug 6%.
Zu dem Zeitpunkt war in der UK kein kommerzieller Impfstoff gegen APP verfügbar. Deshalb entschied man sich, eine bestandsspezifische Vakzine herstellen zu lassen. Als Adjuvanz wurde Aluminiumhydroxid verwendet, das Antigen bestand sowohl aus dem aktuellen A. pleuropneumoniae Isolat als auch aus einem älteren Stamm - beide wurden als Serotyp 8 typisiert.
Angesichts der betroffenen Altersgruppe wurden die Schweine mit 9 und mit 12 Wochen zweimal geimpft, außerdem erhielten die Jungsauen vor Ankunft den Impfstoff.
Verlauf nach der Impfung
Zunächst konnte die Impfanwort als gut bewertet werden. Die klinischen Symptome und Verluste wurden weniger, zudem reduzierten sich die Pleuritis-Befunde am Schlachthof innerhalb von sechs Monaten um 15%. Die routinemäßige Behandlung über das Futter wurde eingestellt. Die Jungsauengesundheit und -reproduktion verbesserte sich auf ein akzeptables Niveau.
Allerdings traten 12 Monate nach Einführung der Impfung wieder klinische Symptome auf. Diesmal waren jüngere Schweine mit 10-12 Wochen betroffen, daher wurde der Impfzeitpunkt auf die 5. und 8. Lebenswoche vorverlegt. Daraufhin besserte sich die klinische Situation wieder und die Futtermedikation konnte erneut eingestellt werden. Die Schlachtgewichte wurden wieder planmäßig erreicht, sodass der Strohstall auch nicht mehr benötigt wurde. Nach 12 Monaten traten jedoch erneut Krankheitssymptome bei noch jüngeren Tieren mit 8-9 Wochen auf. Anstatt die Impfung bei den Ferkeln immer weiter vorzuverlegen, wurde beschlossen, den Impfplan zu verändern. Demnach sollten nun nur noch die Sauen geimpft werden. Dazu wurden zunächst einige Impfversuche bzgl. der Dosis durchgeführt wurden, um Probleme bei tragenden Sauen auszuschließen. Danach wurden die Sauen 5 und 2 Wochen vor der Abferkelung geimpft. Bei den Ferkeln von den geimpften Sauen konnten keine klinischen Symptome beobachten werden.
Dieser Zustand hielt allerdings nicht lange an und so traten die ersten APP-Fällen nach einigen Monaten wieder bei 12-14 Wochen alten Läufern auf.
Aus diesem Grund wurde die Notwendigkeit diskutiert, nicht nur die Sauen vor der Abferkelung sondern auch die Ferkel in der 9. und 12. Lebenswoche zu impfen. Der Betriebsleiter stimmte nur widerwillig dieser Maßnahme zu. Doch bevor die neue Impfstrategie beurteilt werden konnte, ereignete sich auf dem Bestand ein verheerender Brand. Das Feuer begann im Abferkelstall 2 und griff dann auf den Wartestall 2 und Maststall 1 über. Alle Tiere in diesen Gebäuden verendeten. Der restliche Tierbestand wurde verkauft und der Betrieb aufgelöst.
Diskussion
Obwohl der Bestand ursprünglich nicht als frei von APP aufgebaut wurde, traten in den ersten vier Jahren keine klinischen Hinweise einer Infektion auf. Ein akuter Influenza-Einbruch könnte als Wegbereiter für A. pleuropneumoniae gewirkt haben, wodurch APP sich zu einem langfristigen Bestandsproblem entwickelte.
Da die klinischen Symptome zunächst nur bei Tieren um die 14.-16. Lebenswoche auftraten, wurde angenommen, dass die jüngeren Ferkel durch kolostrale Antikörper der Sauen geschützt waren. Nachdem man die Erkrankung in der Vormast durch die Impfung unter Kontrolle gebracht hatte, breiteten sich weniger Infektionen aus den Mastabteilen auf die Wartebereiche aus. Dadurch sank die Immunität der tragenden Sauen und infolgedessen auch der Gehalt an Antikörpern im Kolostrum, wodurch letztendlich die Krankheit bei den jüngeren Tieren ausbrach. Die daraufhin eingeführte Sauenimpfung boosterte die Sauenimmunität und damit den Transfer maternaler Antikörper auf die Ferkel, wodurch der Infektionszeitpunkt wieder auf die älteren Läuferschweinen verlagert wurde.
Die Haltung mehrerer Altersgruppen an einem Standort, die unmittelbare Nähe der Gebäude, das Lüftungsdesign und die hohen Besatzdichten spielten eine entscheidende Rolle bei der dynamischen Ausbreitung der enzootischen Infektion im Bestand, welche zunächst durch einen primären Krankheitsausbruch ausgelöst und danach durch Veränderung der Immunbalanz aufgrund des Einsatzes einer bestandsspezifischen Vakzine und Anpassung der Impfzeitpunkte aufrechterhalten wurde.






