Verfügbare Assays
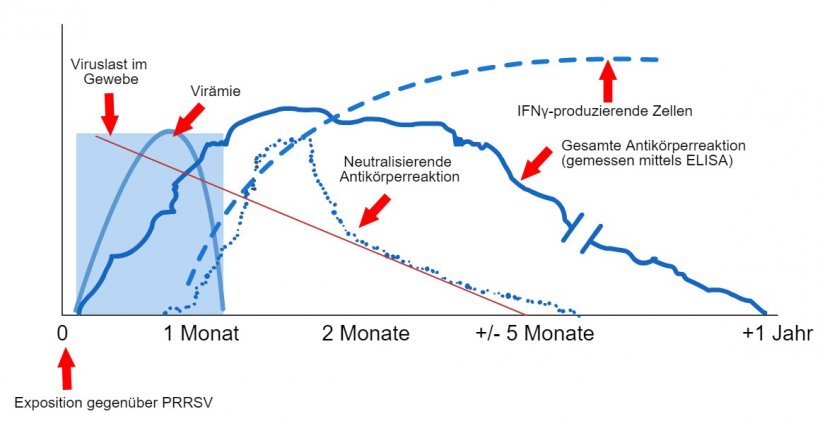
Schema des Virus- und Antikörpernachweises nach Exposition gegenüber PRRSV: Die folgende Grafik zeigt die Veränderungen der Konzentration (Y-Achse) im Laufe der Zeit (X-Achse) verschiedener Analyten, die in Assays verwendet werden. Nach der Exposition gegenüber dem PRRS-Virus findet man das Virus je nach Alter und Immunstatus des Schweins oft zwischen 2 und 4 Wochen lang im Blut der Schweine (Virämie). Die Serokonversion (Antikörpernachweis) erfolgt in der Regel zwischen 7 und 10 Tagen nach der Exposition und hält mehrere Monate an, bevor die Tiere wieder seronegativ werden. Neutralisierende Antikörper treten zwischen 4 und 6 Wochen nach der Exposition auf (López und Osorio, 2004).

Polymerase-Kettenreaktion (PCR)
- Weist das Vorhandensein einer spezifischen Sequenz viraler Nukleinsäure (RNA) nach
- Probentypen: Gewebe, Vollblut, Serum, orale Flüssigkeiten etc.
- Vorteile:
- Es werden separate Primer verwendet, um in der gleichen Probe zur gleichen Zeit PRRSV Typ 1 (europäisch) und PRRSV Typ 2 (nordamerikanisch) nachzuweisen.
- Sehr hohe Empfindlichkeit (kann kleine Mengen von Viren erkennen)
- Frühzeitige Erkennung – akute Fälle sollten positiv sein
- Es können viele verschiedene Probentypen verwendet werden (Gewebe, Blut, Serum, orale Flüssigkeiten etc.).
- Moderate Kosten:
- Um die Kosten zu senken und gleichzeitig die Verringerung der Empfindlichkeit zu minimieren, können oft 5 Serum- oder Gewebeproben gepoolt werden.
- Häufig werden orale Flüssigkeiten nicht gepoolt, da höhere Ct-Werte (niedrigere Viruskonzentrationen) erwartet werden, was zu einer starken Verringerung der Empfindlichkeit führen kann.
- Nachteile:
- Das Labor muss die Primer regelmäßig aktualisieren, um falsch negative Testergebnisse zu vermeiden.
- Sowohl PRRSV-Typ-1- als auch PRRSV-Typ-2-Primer müssen aktualisiert werden.
- Sequenzierung erforderlich, um zwischen Impfvirus- und Wildvirusinfektion zu unterscheiden
- Das Labor muss die Primer regelmäßig aktualisieren, um falsch negative Testergebnisse zu vermeiden.
Enzyme-linked Immunosorbent Assay (ELISA)
- Erkennt das Vorhandensein von Antikörpern
- Probentypen: Serum oder orale Flüssigkeiten (einige Kits)
- Vorteile:
- Die meisten erkennen Antikörper sowohl für PRRSV Typ 1 als auch für PRRSV Typ 2
- Die Tiere bleiben mehrere Monate (3-12 Monate) lang positiv
- Kann in chronischen Fällen verwendet werden
- Nachteile:
- Die nachgewiesenen spezifischen Antikörper und der Zeitpunkt des Nachweises können zwischen den verschiedenen im Handel erhältlichen Kits leicht variieren.
- Es dauert 7 bis 10 Tage, bis die Tiere seropositiv werden.
- Unterscheidung zwischen maternalen Antikörpern und Exposition nicht möglich
- Unterscheidung zwischen Impfvirus- und Wildvirusinfektion nicht möglich
Immunhistochemie (IHC)
- Erkennt das Vorhandensein von Virusantigenen
- Probentypen: Gewebe
- Vorteile:
- Erkennt das Virus am Ort der Läsion (guter Nachweis der Krankheitsursache)
- Kann niedrige, mittlere und hohe Virusmengen identifizieren
- Nachteile:
- Es muss eine korrekte Gewebeprobe eingereicht werden
- Benötigt deutlich mehr Viren als die PCR
- Es wird nur eine kleine Gewebeprobe untersucht
Genetische Sequenzierung
- Sequenziert die Nukleinsäuren des Virus, die die genetische Information enthalten (RNA)
- Probentypen: Gewebe, Vollblut, Serum, orale Flüssigkeiten etc.
- Vorteile:
- Kann das Wildvirus von Impfviren unterscheiden
- Kann helfen, die neu eingetragenen Viren von bereits vorhandenen oder früheren Viren zu unterscheiden
- Nachteile:
- Teuer
- Oft wird nur ORF5 sequenziert, also 600 von ~15.000 Basenpaaren
- Proben mit hohen CT-Werten > 34 sind tendenziell schwieriger zu sequenzieren
Tabelle 1: Iowa State University Veterinary Diagnostic Laboratory Sequenzerfolg basierend auf Ct-Werten (Zyklusschwellenwerten) von PRRSV-PCRs an Proben oraler Flüssigkeit. Tabelle aus Chris Rademacher et al. 2016.
| Probe | PCR Ct-Bereich | Getestete Proben insgesamt | Anzahl der sequenzierten Proben | % Proben positiv sequenziert |
|---|---|---|---|---|
| Alle Proben | <30 | 2016 | 2013 | 99,85 |
| 30,00-31,99 | 389 | 361 | 92,80 | |
| 32,00-33,99 | 324 | 265 | 81,79 | |
| 34,00-35,99 | 185 | 109 | 58,92 | |
| 36,00-37,00 | 65 | 26 | 40,00 |
Indirekter Immunfluoreszenz-Assay (IFA)
- Erkennt das Vorhandensein von Antikörpern
- Probentypen: Serum
- Vorteile:
- Kann zusammen mit einem PCR-Test als Bestätigungstest für unerwartete positive ELISA-Testergebnisse dienen.

Diagramm zur Veranschaulichung des Einsatzes eines PRRSV-IFA als Bestätigungstest bei unerwartet positiven Testergebnissen aus PRRSV-ELISA-Tests. Eine negative Verdachtsprobe, die ein negatives ELISA-Testergebnis ergab, gilt als negativ. Wenn diese Probe unerwartet positiv getestet wird, kann ein PRRSV-IFA als Bestätigungstest durchgeführt werden. Das heißt, wenn der IFA-Test positiv ist, bestätigt dies, dass die Probe positiv ist. Wenn der IFA-Test negativ ist, würden wir davon ausgehen, dass es sich um ein falsch positives Ergebnis handelt, solange die PCR ebenfalls negativ ist, um zu bestätigen, dass vor Kurzem keine Infektion erfolgte.
- Kann zusammen mit einem PCR-Test als Bestätigungstest für unerwartete positive ELISA-Testergebnisse dienen.
- Nachteile:
- Bei großer Anzahl von Proben nicht durchführbar
- Ergebnisse werden durch das für den Assay verwendete Virusisolat beeinflusst
- Zuverlässigkeit hängt stark von den Fertigkeiten des Labortechnikers ab
Interpretation der Ergebnisse
PCR
- Positiv: Virus ist vorhanden/zirkuliert und ist sehr wahrscheinlich die Krankheitsursache, insbesondere bei niedrigeren Ct-Werten, und klinische Symptome sind vorhanden. Eine kürzlich erfolgte Impfung mit einem modifizierten Lebendvirus kann zu positiven PCR-Ergebnissen führen.
- Negativ: Negativ oder Virus könnte übersehen worden sein, wenn der Test erst spät nach der Infektion erfolgt.
ELISA
- Positiv: Maternale Antikörper oder frühere Exposition gegenüber dem Impf- oder Wildvirus (normalerweise > 7-10 Tage nach der Exposition)
- Negativ: Negativ oder Infektion zu früh, um erkannt zu werden (Test muss normalerweise mindestens 7-10 Tage nach der Exposition erfolgen)
IHC
- Positiv: Virus ist an der Läsionsstelle vorhanden
- Negativ: Negativ oder Virus könnte übersehen worden sein, wenn der Test spät nach der Infektion erfolgt
Genetische Sequenzierung
- Impfvirus: Zu erwarten > 99 % Homologie
- Wildvirus: Es ist mit einer Verminderung der Homologie von etwa 1-2 % pro Jahr zu rechnen.
IFA

- Positiv: Maternale Antikörper oder frühere Exposition gegenüber dem Impf- oder Wildvirus (> 7-10 Tage nach der Exposition)
- Negativ: Negativ auf Impfvirus oder Wildvirus oder Infektion zu früh zum Nachweis (muss mindestens 7-10 Tage nach der Exposition erfolgen)
Szenarien
Aborte bei Sauen/Jungsauen
- Abortierte Föten: Beproben Sie 6-8 Föten und poolen Sie die Proben für den PCR-Test. Nur etwa 50 % der abortierten Föten werden PCR-positiv sein (daher müssen viele Föten beprobt werden). Diejenigen, die positiv sind, haben aber eine hohe Viruskonzentration und können deshalb für die PCR-Tests in Zehnergruppen gepoolt werden.
- Sauen/Jungsauen, die Aborte hatten: Sammeln Sie für die PCR-Tests Serum von Sauen/Jungsauen, die vor Kurzem (< 10 Tage) einen Abort hatten. Die Proben können in Fünfergruppen gepoolt werden. ELISA-Tests sind nicht sinnvoll, da es normalerweise 7-9 Tage dauert, bis naive Sauen/Jungsauen positive Testergebnisse liefern.
Reproduktionsprobleme bei Sauen/Jungsauen
- Sammeln Sie 15 bis 20 Proben von erkrankten und 15 bis 20 Proben von nicht erkrankten Jungsauen/Sauen (insgesamt 30 - 40 Proben) und testen Sie diese mittels PCR (Pools von 5 oder 6) und ELISA (einzeln).
Lebensschwache Ferkel im Abferkelstall
- Von mehreren Würfen mit lebensschwachen Ferkeln können orale Flüssigkeiten der gesamten Schweinefamilie gesammelt und mittels PCR getestet werden.
- Von den Ferkeln können Hoden (falls kastriert), Schwänze, Zungengewebe (bei toten Ferkeln) aus verschiedenen Würfen im Abferkelstall gesammelt werden. Für den Test kann man eine große Anzahl von Proben zusammenbringen.
- Sammeln Sie Serumproben von 10 infizierten Würfen, indem Sie 2 bis 3 Ferkel pro Wurf beproben und mittels PCR an Gruppen von 5 oder 6 Ferkeln testen. Stellen Sie sicher, dass die Ferkel nicht gegen PRRS geimpft worden sind.
Mastschwein mit akuten klinischen Symptomen von PRRS
- Sammeln Sie orale Flüssigkeiten von 4 bis 6 verschiedenen Buchten und führen Sie mittels PCR individuelle Tests durch. Poolen Sie für den Test keine Proben.
- Sammeln Sie 15 bis 30 Serumproben von Schweinen mit klinischen Symptomen oder Stichproben und testen Sie mittels PCR. Kann für den PCR-Test in Gruppen von 5 oder 6 Ferkeln gepoolt werden.
Mastschweine mit chronischen klinischen Symptomen von PRRS
- Sammeln Sie orale Flüssigkeiten von 4 bis 6 verschiedenen Buchten und führen Sie mittels PCR individuelle Tests durch. Poolen Sie für den Test keine Proben. Sie können orale Flüssigkeitsproben auch mittels ELISA testen.
- Sammeln Sie 30 Serumproben von Schweinen mit klinischen Symptomen oder Stichproben und testen Sie mittels PCR. Kann für den PCR-Test in Gruppen von 5 oder 6 Ferkeln gepoolt werden. Testen Sie auch einzelne Proben mittels ELISA, um die Exposition zu bestätigen.