Enzyme-linked Immunosorbent Assay (ELISA)
Der ELISA ist der wohl am häufigsten zum quantitativen Nachweis von Antikörpern gegen Pathogene in biologischen Flüssigkeiten verwendete Immunoassay. Er zeichnet sich durch hohe Spezifität und Sensitivität aus. Die Durchführung erfolgt mit 96-Well-Mikrotiterplatten und basiert auf der Antigen-Antikörper-Interaktion sowie auf der enzymabhängigen Entwicklungsreaktion (kolorimetrisch, fluorimetrisch oder luminometrisch). Das als optische Dichte (OD) mit einem Spektralphotometer gemessene Signal kann direkt oder umgekehrt proportional zur Konzentration bzw. Menge der nachgewiesenen Antikörper sein.

Zum Nachweis der Gesamt-Antikörper gegen Viren, Bakterien oder Mykoplasmen bedient man sich eines indirekten ELISA, bei dem ein Pathogen an eine feste Phase (Vertiefung der Mikrotiterplatte) gebunden wird. Durch die Inkubation der Probe bildet sich ein Antigen-Antikörper-Komplex. Danach wird ein konjugierter Sekundärantikörper hinzugefügt, um ein Auslesesignal zu erzeugen. Diese Methode ermöglich das Screening vieler Proben mit einem einzigen konjugierten Sekundärantikörper.
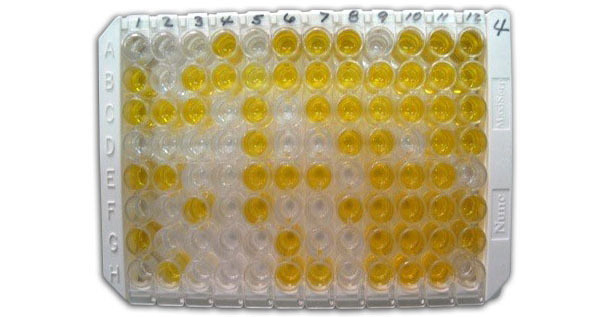
Abbildung 1:Indirekter ELISA zum Nachweis von anti-Chlamydia-Antikörpern im Serum.
Der klassische kompetitive ELISA sowie der kompetitive Hemm-ELISA quantifizieren die in der Probe enthaltenen Antikörper aufgrund deren Fähigkeit, mit einem vortitrierten Assay zu interferieren. Bei beiden Tests wird einem vortitrierten System die Probe hinzugegeben, in der die Antikörperbindungsaktivität anhand des Grades der Interferenz ermittelt wird.
So wird zum Beispiel zum Nachweis der humoralen Immunantwort auf PRRSV das N-Protein des Virus verwendet, um die PRRSV-spezifischen Gesamt-Antikörper einzufangen und in den antigenbeschichteten Vertiefungen der 96-Well-Mikrotiterplatte zu binden. Zur Visualisierung der eingefangenen Anti-PRRSV-Antikörper bedient man sich eines Peroxidase-konjugierten Sekundärantikörpers.
Die humorale Immunantwort variiert von Tier zu Tier und die Konzentration bzw. Menge an detektierten Antikörpern spiegelt nicht zwangsläufig die Virulenz des PRRSV-Isolats wider. Des Weiteren kann eine Interferenz mit maternalen Antikörpern bestehen und zu falsch positiven Ergebnissen führen. Im Allgemeinen ermöglichen ELISA-Antikörper den Nachweis der Gesamt-Antikörper, welche den Pool an zirkulierenden Plasmazellen und pathogenspezifischen Gedächtnis-B-Zellen darstellen. Somit ist der Nachweis der gegen immundominante Epitope gerichteten virusneutralisierenden Antikörper entscheidend für eine korrekte Detektion dieser humoralen Immunantwort. Der Nachweis der Gesamt-Antikörper mittels ELISA kann jedoch nützliche Informationen über die Serokonversion und den Booster-Effekt auf nachfolgende Impfungen und/oder Infektionen liefern.
Virusneutralisationstest
Der Virusneutralisationstest (NT) ermöglicht den Nachweis und die Quantifizierung von virusspezifischen neutralisierenden Antikörpern im Serum. Dabei werden in der Regel eine zweifache Verdünnung der Serumprobe und eine bekannte Menge an Virus vorinkubiert und danach zu Zielzellen hinzugefügt, die für die Virusinfektion empfänglich sind,, sodass.nicht neutralisierte Viren die Zellen infizieren können und die höchste Verdünnung, bei der die Virusinfektion noch neutralisiert werden kann, sowie das Vorliegen eines zytopathischen Effekts ermittelt werden können.
Der Virusneutralisationstest ist hoch sensitiv und spezifisch und misst den Titer der neutralisierenden Antikörper nach Infektion oder Impfung. Die Titerquantifizierung kann auf der Präsenz oder Absenz des zytopathischen Effekts oder dem Nachweis einer Virusinfektion mittels eines immunreaktiven Verfahrens basieren. Der NT eignet sich gut für die Beurteilung des Ausmaßes einer serologischen Kreuzreaktivität zwischen Impfantiseren und Virusisolaten, um eine Beurteilung des Kreuzschutzes vornehmen bzw. eine Korrelation mit den Antikörpertitern herstellen zu können.
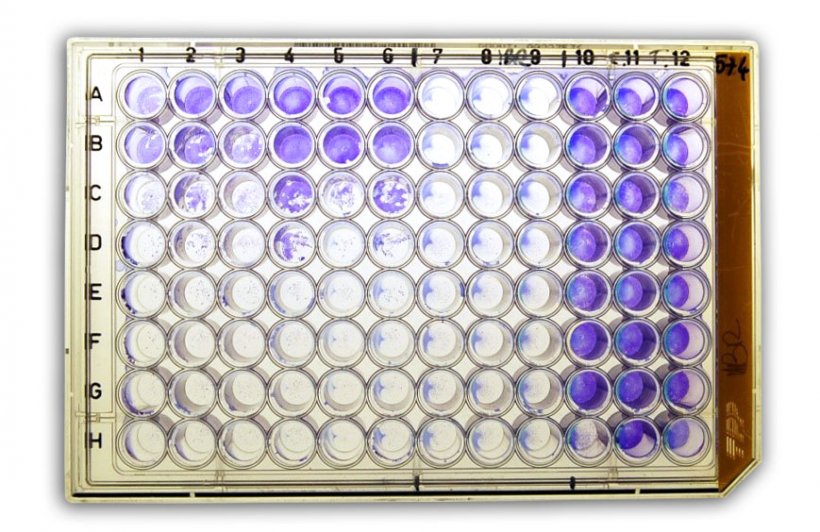
Abbildung 2a: Virusneutralisationstest (NT) zum Nachweis von anti-BHV-1 (bovines Herpesvirus Typ 1)-Antikörpern im Serum.
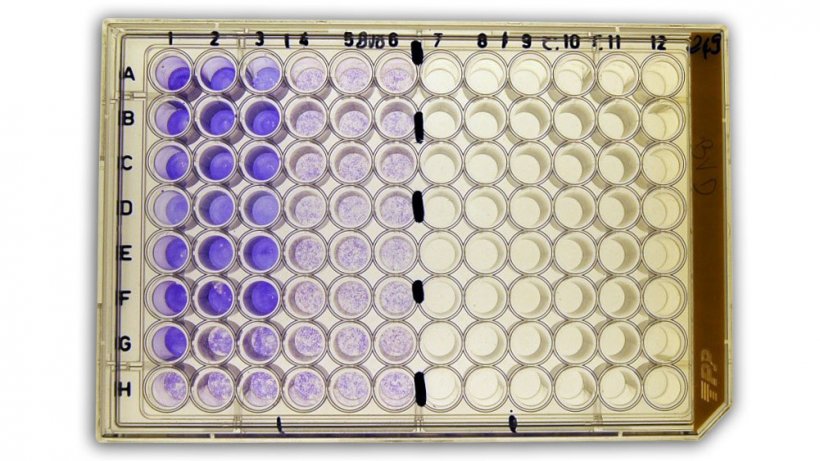
Abbildung 2b: Virusneutralisationstest (NT) zum Nachweis von anti-BVDV (bovines Virusdiarrhö-Virus)-Antikörpern im Serum.
Hämagglutinationstest
Der Hämagglutinationstest ist ein serologisches Testverfahren zum Nachweis von Antikörpern und beruht auf dem Prinzip, dass das Hämagglutinin von Influenzaviren - ebenso wie jenes anderer Viren - einen hämagglutinierenden Effekt auf die Erythrozyten ausübt. Es ist somit die Standardmethode für den Nachweis von anti-Influenza-Antikörpern. Das bedeutet, dass es bei Zugabe dieser Viren zu einer Verklumpung des Blutes kommt, weil die roten Blutkörperchen an das Hämagglutinin an der Oberfläche des Virus binden.

Spezifische Antikörper, deren Bildung als humorale Immunantwort auf eine Infektion oder eine Impfung mit dem Virus induziert wird, können die Agglutination durch Bindung an die Hämagglutinine verhindern.
Wenn die Probe Hämagglutinin-spezifische Antikörper enthält, kommt es bei Zugabe des Influenzavirus zu einer Antigen-Antikörper-Reaktion. Dies wird durch die nachfolgende Zugabe von Erythrozyten sichtbar gemacht. Diese verklumpen nicht mehr, weil die Reaktion gehemmt wurde.
Die Serumtitration kann zur Ermittlung jener Verdünnungen genutzt werden, bei denen die Hämagglutination gerade noch gehemmt wird. Der reziproke Wert der höchsten Verdünnung, bei der die Hemmung der Agglutination noch beobachtet werden kann, liefert den Antikörpertiter.

Abbildung 3: Hämagglutinationstest zum Nachweis von anti-Brucella-Antikörpern im Serum.
Immunoperoxidase Monolayer Assay (IPMA)
Der IPMA ist ein weit verbreitetes Testverfahren zum Nachweis von Antikörpern gegen ein Virus, insbesondere gegen jene Viren, die keinen zytopathischen Effekt aufweisen, wie z.B. PCV-2. Neutralisierende Antikörper (NA) sind die Hauptantikörper, die für den Schutz gegen eine Infektion bzw. für die Clearance einer Infektion verantwortlich sind. Da zwischen IPMA-Antikörpertitern und den Titern für virusneutralisierende Antikörper (VNA) eine positive Korrelation besteht, könnte man die IPMA-Titer als indirektes Maß für die NA-Titer ansehen. Für die Routinediagnostik ist IPMA nicht das Verfahren der Wahl, weil es von mit dem Virus infizierten Zellkulturen abhängig ist und das Screening vieler Serumproben relativ zeitaufwändig ist. Aus diesem Grund wird der IPMA oft durch stärker automatisierte Testverfahren ersetzt, bei denen, wie z.B. beim ELISA, eine objektive Endpunkt-Auslesung verwendet wird.






