Zur Beurteilung der zellulären Immunantwort beim Schwein werden heute verschiedene innovative Labortechniken angewandt. Dazu werden entweder Immunzellen aus dem Blut (mononukleäre Zellen des peripheren Blutes [PBMC]) oder Immunzellen aus peripheren Organen wie Thymus, Lymphknoten, Milz, Darm, Lunge und Knochenmark herangezogen.
Diese Techniken sind in letzter Zeit im Bereich der Veterinärwissenschaft stark verbessert und verfeinert worden und können derzeit sowohl für Anwendungen in der Praxis als auch für die experimentelle Forschung eingesetzt werden. Die Flusszytometrie wird auch in der Kleintieronkologie verwendet.

Eines der am häufigsten verwendeten Verfahren ist der Interferon-gamma Enzyme-linked Immunospot (IFN-γ ELISPOT)-Test, mithilfe dessen die Anzahl IFN-γ-sezernierender Zellen nach Zellstimulierung mit einem viralen Antigen (z.B. PRRSV, PCV2, ADV) oder Mykoplasmen-/Bakterienantigenen (z.B. Mycoplasma hyopneumoniae, Escherichia coli) mit hoher Sensitivität quantifiziert.werden kann.
Die aus dem Vollblut von Tieren, die aufgrund einer vorangegangenen Impfung und/oder einer natürlichen Infektion mit dem Pathogen in Kontakt gekommen sind, isolierten PBMC werden auf die Quantifizierung jener T-Lymphozyten hin getestet, die mit einem Antigen desselben Pathogens oder dem kompletten Erreger selbst (z.B. ganzer Virus) reaktiviert werden.
Dieser Test kann relevante Informationen zum effektiven Aktivierungsstatus des Immunsystems eines Tieres liefern. Tatsächlich lässt sich die virus- oder bakterienspezifische Induzierung von Gedächtniszellen und Effektor-T-Zellen durch die IFN-γ-Sekretion auf Einzelzellbasis nachweisen und auf 96-Well-Mikrotiterplatten darstellen.
Mit der Verwendung des ELISPOT-Tests lässt sich die Immunreaktivität nach klassischen oder innovativen Impfmethoden (z.B. intramuskuläre versus nadellose intradermale Impfung) im Zeitverlauf überwachen. In gleicher Weise ermöglicht der Test ein Monitoring der Immunreaktivität bei Impfplänen und nach Infektionen mit neu auftauchenden Erregerstämmen, um die Immunantwort infizierter Tiere sowie die Wirksamkeit von Vakzinen hinsichtlich des Immunschutzes und Kreuzschutzes zu beurteilen.
Die Beurteilung der zellulären Immunantwort erfolgt anhand der insgesamten Anzahl von Spots, die sich infolge der IFN-γ-Sekretion durch einzelne Zellen bilden, und die Bewertung wird allgemein als die Anzahl IFN-γ-sezernierender Zellen in einer Million getesteter Zellen ausgedrückt. Ist der Test positiv, bedeutet dies, dass das Tier im Feld einem viralen oder bakteriellen Antigen ausgesetzt war und daher dank der Gedächtnis-T-Zellen ein immunologisches Gedächtnis entwickelt hat, das bei erneuter Exposition gegenüber demselben Pathogen einen gewissen Grad an Immunschutz und/oder einen Kreuzschutz bei Pathogenvarianten verleiht.
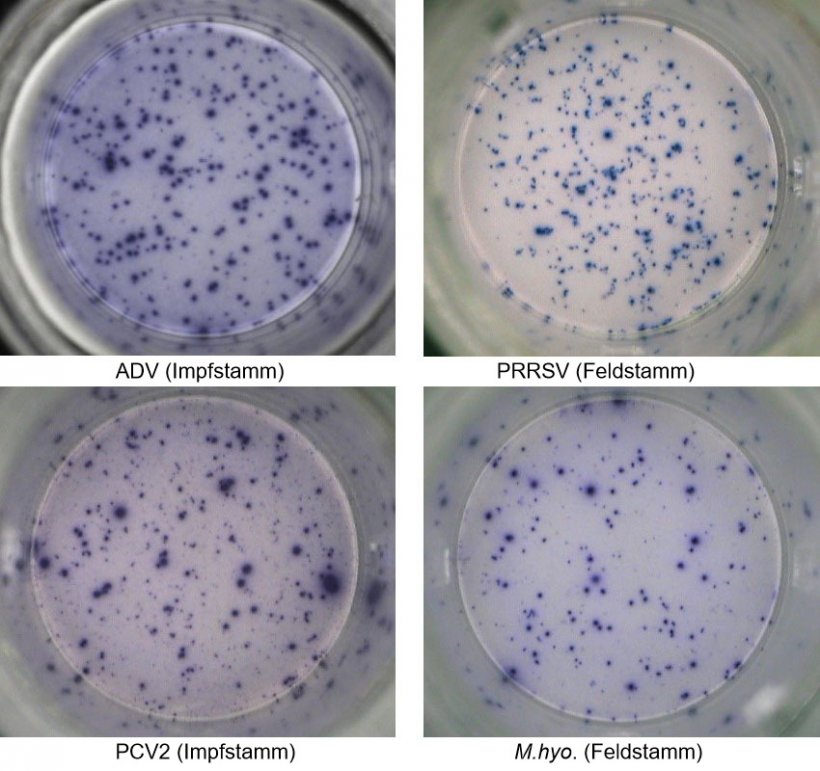
Abb. 1. IFN-γ ELISPOT. Antigen-spezifische Reaktionen bei PBMC auf Schweinepathogene. ADV: Aujeszky-Virus; PRRSV: Porzines-reproduktives-und-respiratorisches-Syndrom-Virus; PCV2: porzines Circovirus Typ 2; M. hyo.: Mycoplasma hyopneumoniae. Jeder Spot ist auf die IFN-γ-Sekretion durch reaktivierte Gedächtnis-/Effektor-T-Lymphozyten zurückzuführen. In Klammern ist das zur Reaktivierung der Zellen in den Testplatten verwendete Pathogen angegeben.
Die Flusszytometrie ist ein sensitives und spezifisches Verfahren zur Identifizierung (Immunphänotypisierung) und Quantifizierung von Immunzellensubpopulationen im peripheren Blut (PBMC) oder von aus Immungeweben oder -organen isolierten Zellen. Diese Zellen werden in der Folge mit Fluorochrom-konjugierten Antikörpern angefärbt, die mit den wichtigsten Oberflächenmarkern oder intrazellulären Immunmarkern reagieren.
Somit lassen sich Veränderungen in solchen Subpopulationen beobachten und überwachen, und zwar sowohl bei spezifischen Therapien im Tierexperiment und/oder bei Feldbehandlungen wie Impfungen oder Verabreichung von Immunstimulanzien oder anderen Arzneimitteln, als auch bei experimentellen oder natürlichen Infektionen. Die in der Regel am häufigsten für die Flusszytometrie verwendeten Marker sind CD (Cluster of Differentiation)-Moleküle, die an der Oberfläche von Immunzellen exprimiert werden, sodass verschiedene Untergruppen von Monozyten (z.B. CD172, CD14, CD16, CD163) und Lymphozyten (CD3, CD4, CD8, CD27, CD1, CD2, CD16, CD14, CD25, CD79) identifiziert werden können.
Zusätzlich kann man durch intrazelluläre Färbung von mit der Aktivierung in Zusammenhang stehenden Molekülen oder von Sekretionsmolekülen wie proinflammatorischen Zytokinen (z.B. IL-1, TNF-α, IL-6), Immunzytokinen (z.B. IL-2, IFN-γ, IL-10) und Expressionsfaktoren (z.B. FoxP3) den Aktivierungsstatus dieser Zellen untersuchen.
So lassen sich durch multiples Anfärben polyfunktionelle, zur gleichzeitigen Produktion zahlreicher Zytokine fähige Untergruppen von Immunzellen identifizieren und bei Infektion untersuchen. Diese Zellen scheinen von Relevanz für die Regulierung der Clearance von Pathogenen und den Schutz gegen Erreger zu sein.
![Abb. 2. Flusszytometrie. Beispiele für Immunzellphänotypen, die als Prozentsatz oder in absoluten Zahlen bei Schweinen quantifiziert wurden [Anzahl Zellen/ml Blut]. PBMC: a-c) T -Lymphozytensubpopulationen: CD3+CD4+CD8- = T-Helferzellen (Th) CD3+CD4+CD8+ = Gedächtnis-T-Zellen CD3+CD4-CD8+ = zytotoxische T-Lymphozyten (CTL) d-e) proinflammatorische Monozytensubpopulationen: CD172+CD14+CD16+ CD172+CD16+CD163+ CD172+CD14+CD163+ f-g) CD4+CD25+FoxP3+ = regulatorische T-Lymphozyten (Tregs).](https://www.3drei3.de/3tres3_common/art/de/1965/flusszytometrie_133245.jpg?w=820&q=1&t=1653979446)
Lymphozytenproliferationstest: Nach In-vitro-Stimulation mit mitogenen polyklonalen (aspezifischen) und monoklonalen (z.B. virus- und bakterienspezifischen) Aktivatoren kann die Reaktivität der T-Lymphozyten auf einfache Art und Weise beurteilt werden, wenn ein Tier einer Behandlung unterzogen wird, die die Reaktion auf jene Mitogene oder pathogene Antigene verändern kann, die eine Proliferation triggern und eine Verschiebung von ruhenden zu aktivierten proliferierenden Zellen (Lymphoblasten) induzieren.
Die Bewertung der Lymphozytenproliferation kann durch einen MTT-Test (Inkorporation und Farbänderung eines Reagens durch proliferierende Zellen) erfolgen, aber auch mittels Flusszytometrie durch Quantifizierung der großen Lymphoblasten und/oder Inkorporation von fluoreszierenden Reagenzien nach In-vitro-Stimulation während 2-5 Tagen.

DieTetramer-Technologie ist bei Schweinen für die Quantifizierung von antigenspezifischen zytolytischen/zytotoxischen CD8+-T-Lymphozyten mittels Flusszytometrie eingesetzt worden, sowie in jüngerer Zeit zur Quantifizierung von antigenspezifischen B-Gedächtniszellen.
Diese Technologie basiert auf der Verwendung von Antigen-beladenen fluoreszierenden Makromolekülen, die einer gemischten Immunzellenpopulation ausgesetzt werden, um mit jenen B- und T-Zellen zu interagieren, die selektiv ein Antigen erkennen und vermutlich für die Effizienz der zellulären Immunantwort und die Eliminierung des Erregers bzw. dessen mengenmäßige Reduzierung im Organismus der Tiere verantwortlich sind. Die Tetramer-Technologie ist eine hoch spezifische und sensitive Methode, die in der Lage ist, auch kleine Fraktionen von B- und T-Gedächtniszellen nachzuweisen. Sie wurde z.B. für die Detektion von Maul-und-Klauenseuche-Virus (FMDV/MKSV)-spezifischen und Schweineinfluenza-Virus (SIV)-spezifischen zytotoxischen CD8+-T-Lymphozyten und PRRSV-spezifischen B-Gedächtniszellen entwickelt..
Der Zytotoxizitätstest basiert auf dem Einsatz von zytolytischen/zytotoxischen T-Effektorzellen (E), die zunächst isoliert und dann für 3-4 Tage in 96-Well-Mikrotiterplatten mit den Zielzellen (T) in verschiedenen Verhältnissen (E/T) inkubiert werden. Die Effizienz der Zytolyse liefert Informationen über das immunologische Potenzial der Effektor-T-Zellen gegenüber den in vivo potenziell infizierten Zielzellen.





