Streptococcus suis (S. suis) ist ein endemischer zoonotischer Erreger, gegen den es keine adäquate nicht-antibiotische Prophylaxe für Zuchtschweine gibt. Die Pathogenese ist hauptsächlich mit der Besiedlung der oberen Atemwege und der Mandeln als Eintrittspforte zum Kreislaufsystem verbunden (Segura et al., 2016), obwohl eine gastrointestinale Infektion nicht auszuschließen ist (Swildens, 2009). Die Besiedlung erfolgt bei der Geburt, während der Aufzuchtphase, wenn die Ferkel mit anderen Würfen gemischt werden, und bei Krankheitsausbrüchen. Interessanterweise stehen Krankheitsausbrüche häufig mit Koinfektionen und Stressfaktoren in Verbindung, die als mögliche Auslöser identifiziert werden. Der natürliche Infektionsprozess ist jedoch nicht vollständig geklärt, und es fehlt uns ein wiederholbares Versuchsmodell, um die ersten Schritte der Krankheit nachvollziehen zu können. Die Erkrankung wird am häufigsten an den neurologischen Symptomen einer Meningitis erkannt, die Bewegungseinschränkungen und eine hohe Sterblichkeit umfassen.
Aus Human- und Tiermodellen ist bekannt, dass die Entzündungsreaktion in den Hirnhäuten durch einen verringerten Glukosegehalt und einen erhöhten Laktatgehalt im Liquor cerebrospinalis (CSF) gekennzeichnet ist. Die Entzündung der Blut-Hirn-Schranke (BHS) und der Blut-Liquor-Schranke (BLS) beeinträchtigt die Hirnfunktion, den Ionenaustausch und die Mineralstoff-Homöostase im gesamten System (Bettinelli et al., 2012). In diesem Zusammenhang wissen wir nicht, wie die Bedingungen bei auf natürliche Weise infizierten Ferkeln aussehen. Diese Informationen könnten dazu beitragen, Anfälligkeitsfaktoren zu ermitteln und Strategien zur Förderung der Gesundheit und Genesung kranker Ferkel zu definieren.

Das Ziel dieser Studie bestand in der Untersuchung verschiedene Verdachtsfälle einer S. suis-Infektion in unserem Schweineforschungszentrum, und zwar mit folgenden Unterzielen:
- Diagnostizierung der Krankheitsausbrüche
- Bewertung der relativen Auswirkungen der Krankheit
- Gewinnung neuer Erkenntnisse zur Pathophysiologie der Krankheit
Unser Forschungsbetrieb umfasst ca. 160 produktive Sauen, die in Partien mit einem 4-5-Wochenrhythmus eingeteilt sind und etwa 560 Ferkel pro Partie produzieren, wobei das Absetzalter etwa 24 Tage beträgt. Studien zu Fütterung und Management laufen kontinuierlich und gleichzeitig in verschiedenen Abteilungen, darunter trächtige Sauen, laktierende Sauen, Saugferkel und Absetzferkel (in konventionellen Buchten mit n = 3-6 Schweinen/Bucht oder mit elektronischen Fütterungssystemen mit n = 10-12 Schweinen/Bucht; überall PVC-Roste).
Wenn klinische Anzeichen auftraten, die mit einer Streptokokkenerkrankung vereinbar waren, wurden Blutproben und Tonsillenabstriche von zwei Schweinen pro Bucht (einem erkrankten Schwein und einem zufällig ausgewählten Schwein entnommen. Anschließend wurden die kranken Schweine 3 Tage lang mit Ampicillin und Dexamethason behandelt. Fälle mit Funktionsstörungen des zentralen Nervensystems wurden mit Meningitis in Verbindung gebracht und als schwer krank definiert (u. a. Gleichgewichtsverlust, Ataxie, Lähmung, Opisthotonus, generalisierter Tremor und Ruderbewegungen). Andere Fälle mit nicht-neurologischen Symptomen umfassten Niedergeschlagenheit, Hautrötung und Lahmheit, die wahrscheinlich mit Septikämie und Arthritis zusammenhingen. Die nach dem Zufallsprinzip ausgewählten Stallgenossen dienten als Kontrolltiere. Die Blutproben wurden innerhalb von 5 Minuten nach Feststellung der klinischen Symptome entnommen. Blut und Serum wurden auf Gase und Mineralstoffe untersucht. Die Tonsillenabstriche wurden mittels qPCR auf die S. suis-Serotypen 2 (und/oder 1/2), 7 und 9 untersucht. Das Körpergewicht der Ferkel wurde zum Zeitpunkt der Probenahme und nach 7 Tagen ein weiteres Mal gemessen. Ferner wurden retrospektive Daten in unseren Betriebsaufzeichnungen gesucht.
Die Studie umfasste drei Hauptausbrüche in den Partien Winter (3,8 % Inzidenz), Frühjahr (5,3 % Inzidenz) und Herbst (9 % Inzidenz). Bei jedem Ausbruch wurde der S. suis-Serotyp 2 (oder 1/2) diagnostiziert und mittels kulturellem Erregernachweis oder DNA-Nachweis per qPCR im Gewebe (Herzklappen, Gelenke, Hirnhaut) von euthanasierten oder verendeten Schweinen bestätigt. Bei Schweinen, die behandelt wurden und überlebten, wurde jedoch keine Diagnose gestellt. Außerdem wurden im Rahmen dieser Studie nicht alle Schweine mit klinischen Symptomen beprobt; Fälle, die am Wochenende entdeckt wurden oder bei denen keine personellen Ressourcen für eine angemessene Probenahme zur Verfügung standen, wurden ausgeschlossen und sofort medikamentös behandelt.
Insgesamt wurden 56 Schweine beprobt, darunter 28 Schweine mit Verdacht auf S. suis, die klinische Symptome aufwiesen, von denen 20 Ferkel als schwer krank eingestuft wurden (neurologische Symptome). Die Daten beziehen sich nur auf die neurologisch erkrankten Schweine im Vergleich zur Kontrollgruppe (Abbildung 2 A und B).
Die Kontrolltiere und die erkrankten Schweine hatten ein ähnliches Körpergewicht und Alter zum Zeitpunkt des Auftretens der klinischen Symptome und unterschieden sich im Nachhinein nicht in Bezug auf das Absetzgewicht oder die durchschnittliche Tageszunahme zwischen Absetzen und Probenahme (P > 0,05), was darauf schließen lässt, dass es keine eindeutige Vorbedingung für extrem schlechte oder gute Leistungen gibt. In den 7 Tagen nach der Feststellung der Krankheit verringerte sich die Leistung der Schweine erwartungsgemäß (P < 0,05).
Retrospektiv wurde ein signifikanter Wurf/Sau-Effekt mit einem höheren Anteil an Geschwisterferkeln bei den neurologisch erkrankten Schweinen als bei den Kontrolltieren beobachtet (P < 0,02), was allgemein bekannt ist und auf den Effekt der Sau bei der vertikalen Transmission des Trägertums hinweist, aber möglicherweise auch einen Anfälligkeitsfaktor darstellt. Bei der Leistung der Sauen wurde kein Unterschied zwischen kranken bzw. neurologisch betroffenen Schweinen und den Kontrolltieren festgestellt, was die Vorhersagbarkeit potenzieller Risikofaktoren anhand der Sauenleistung verringert (Daten nicht gezeigt). Die Prävalenz des S. suis-Serotyps 2 war bei schwer erkrankten Schweinen (81 %) im Vergleich zur Kontrollgruppe (44 %) signifikant erhöht (P < 0,04), was mit unseren diagnostischen Ergebnissen übereinstimmt.
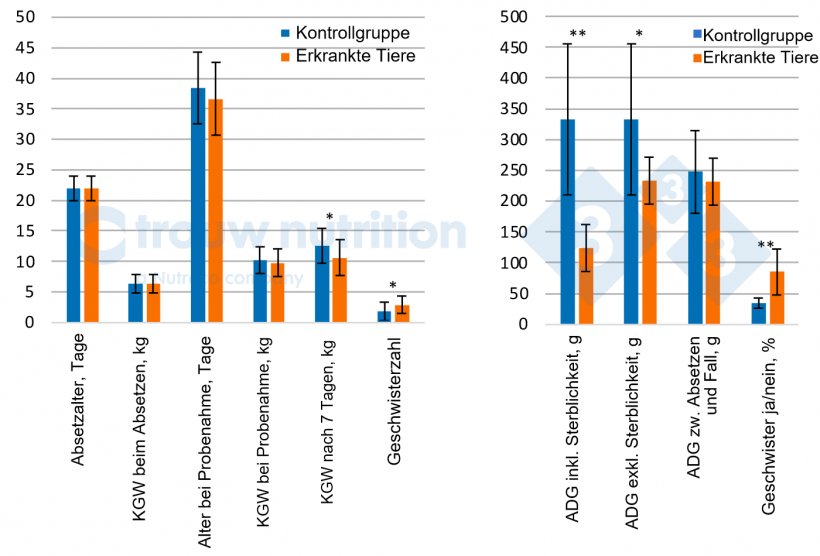
Abb. 1: Tierleistung und Wurfgeschichte von erkrankten Schweinen mit neurologischen Symptomen (n = 20) im Vergleich zur Kontrollgruppe (n = 28). KGW = Körpergewicht, ADG = Durchschnittliche Tageszunahme zwischen: Geschwisterzahl = Anzahl der Geschwister im Datensatz. Die Schweine erhielten 0, 1, 2, 3, 4, 5..., wenn sie 0, 1, 2, 3, 5 oder 4 Geschwister hatten.
Bei den Blutparametern von erkrankten Schweinen mit neurologischen Symptomen wurde ein allgemeines pathophysiologisches Profil beobachtet (Tabelle 1), das einen erhöhten pH-Wert, eine erhöhte O2-Sättigung und das Auftreten einer Alkalose aufwies, während der Gehalt an Glukose, pCO2, iCa, Ca, P, Mg, K und Na im Blut/Serum im Vergleich zur Kontrollgruppe geringer war (P<0,05). Die beobachtete respiratorische Alkalose stand wahrscheinlich im Zusammenhang mit einer Ansäuerung des Liquors (Laktatakkumulation) durch Pleozytose (erhöhte Anzahl weißer Blutkörperchen im Liquor). Meningitis kann ein zerebrales Salzverlustsyndrom verursachen, das zu Störungen des sympathischen Systems, der Diurese und der Nierenfunktion führt, was den Mineralstoffverlust in dieser Studie erklärt.
Tabelle 1: Hauptunterschiede bei der biochemischen Blutanalyse und der Mineralstoffanalyse im Blut bzw. Serum von erkrankten Schweinen mit neurologischen Symptomen (n = 20) und Kontrolltieren (n = 28)
| Kontrolgruppe | Erkrankte Tiere | QMDM | p-Wert | |
|---|---|---|---|---|
| pH (Blut) | 7,30 | 7,41 | 0,095 | <,001 |
| PCO2 (Blut), mmHg | 52,5 | 41 | 9,858 | <,001 |
| PO2 (Blut), mmHg | 35,5 | 39,4 | 11,69 | 0,258 |
| sO21 (Blut), mmol/l | 57,1 | 67,6 | 17,16 | 0,045 |
| Basenüberschuss (Blut), mmol/l | -1,39 | 1,4 | 4,875 | 0,062 |
| Alkalose-Inzidenz, % | 10,7 | 42,2 | 13,2 | 0,019 |
| Na (Blut), mmol/l | 139 | 137 | 3,265 | 0,008 |
| K (Blut), mmol/l | 5,21 | 4,49 | 0,791 | 0,004 |
| iCa (Blut), mmol/l | 1,38 | 1,27 | 0,066 | <,0001 |
| Ca (Serum), mmol/l | 2,59 | 2,33 | 0,151 | <,0001 |
| Glukose (Blut), mg/l | 117,5 | 82,3 | 21,51 | <,0001 |
Niedrige Na-Werte sind mit einem höheren Risiko für eine schwerere Erkrankung und eine höhere Sterblichkeitsrate bei Kindern mit Meningitis verbunden (Chao et al., 2008), und niedrige Ca-Werte (gesamt und ionisiert) treten häufig bei Kindern mit schweren Meningokokkenerkrankungen auf. Mg interagiert mit der Parathormonsekretion als Reaktion auf eine Hypokalzämie und könnte zu der in dieser Studie festgestellten schlechten Mineralstoff-Homöostase beitragen.
Es kann spekuliert werden, dass eine Mineralstoff- und Elektrolytbehandlung, wie sie derzeit bei menschlichen Meningitis-Patienten durchgeführt wird, auch bei Schweinen von Vorteil sein könnte, und es sind weitere Forschungen in dieser Richtung erforderlich, wobei kontrollierte Infektionsstudien anstelle von Studien aus der Praxis wie in diesem Fall verwendet werden sollten.
Zusammenfassend lässt sich sagen, dass die Meningitis bei natürlich erkrankten Ferkeln mit einer durchschnittlichen Leistung verbunden war, ohne dass irgendein vor der Erkrankung bestehendes Leistungsmerkmal hervorzuheben wäre, abgesehen vom Sauen/Wurf-Effekt. Erkrankte Ferkel zeigten respiratorische Alkalose, Mineralstoffverlust und eine erhöhte Prävalenz des S. suis-Serotyps 2 (und/oder 1/2).
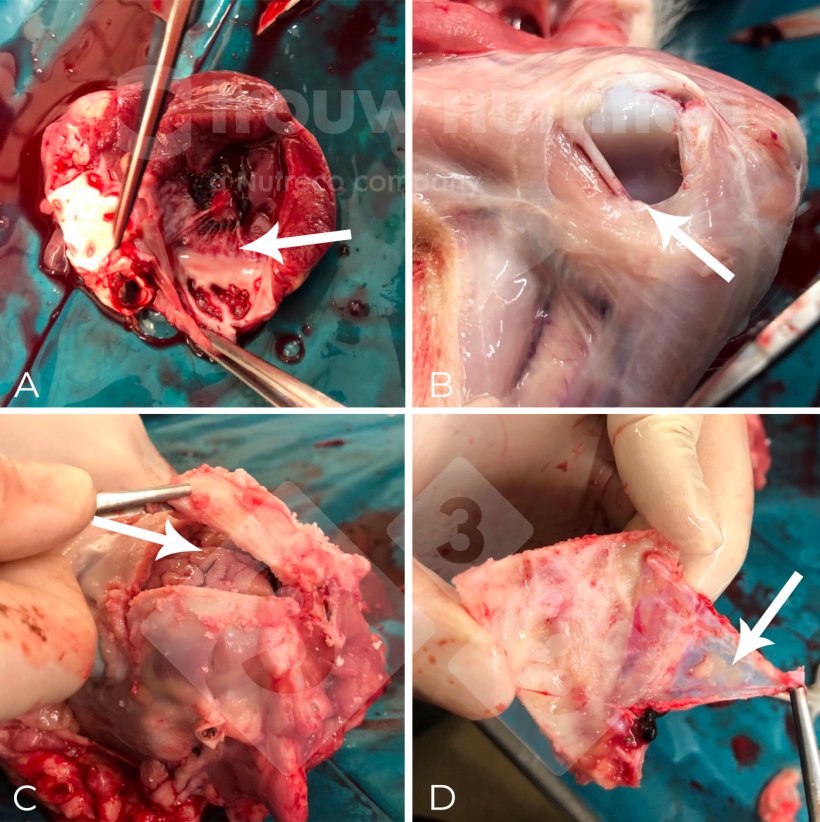
Abb. 2: (A-C) Probenahmestellen bei der Nekropsie sowie makroskopisches Erscheinungsbild einer diffusen fibrinosuppurativen Meningitis (D). Der ätiologische Erreger wurde durch Serotypisierung als Streptococcus suis Serotyp 2 und durch Multi-Locus-Sequenztypisierung (MLST) als Sequenztyp 1 bestätigt.

Metabolic insights and background from naturally affected pigs during Streptococcus suis outbreaks. Fabà L, Aragón V, Litjens R, Galofré-Milà N, Segura M, Gottschalk M, Doelman J. Translational Animal Science, Volume 7, Issue 1, 2023, txad126.