In unserer vorherigen Behandlung des Themas haben wir hervorgehoben, wie schwierig es ist, wissenschaftlich fundierte Studien über die Mikrobiota von Schweinen durchzuführen. Trotzdem wurde eine immer größere Anzahl von Studien zu diesem Thema veröffentlicht (Abb. 1). Da immer mehr Informationen zur Verfügung stehen, stellt sich die Frage, wie Sie diese Daten verstehen und in den Ställen sinnvoll nutzen können.

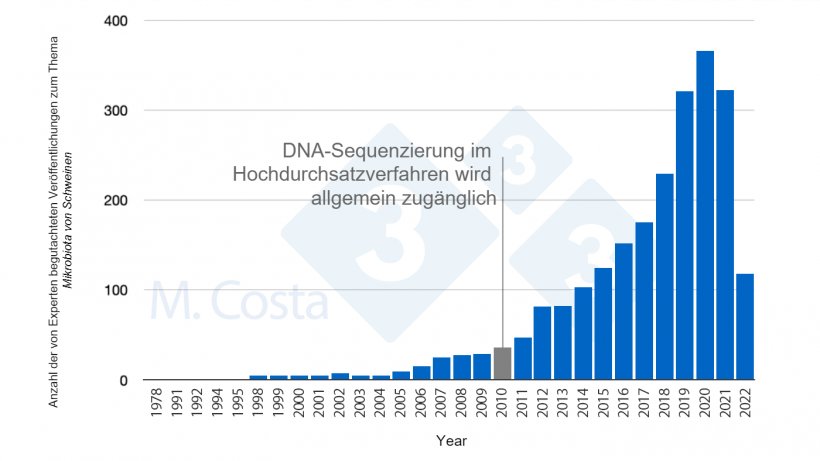
Abbildung 1: Anzahl der in den letzten 50 Jahren veröffentlichten, von Experten begutachteten Studien zur Mikrobiota von Schweinen
Schritt 1 – Kennen Sie Ihre Bedingungen
In Mikrobiomstudien werden einige Schlüsselkennzahlen verwendet, die es uns erleichtern, die Ergebnisse zu verstehen. Viele sind der Makroökologie entlehnt. Schließlich unterscheidet sich eine Gemeinschaft von Bakterien im Darm nicht wesentlich von einem Fischschwarm im Meer. Beide stehen in Beziehung zu ihrer Umgebung und zu anderen Lebewesen, die den Lebensraum mit ihnen teilen. Daher ermöglicht das Verständnis dieser Kennzahlen eine korrekte Interpretation von Experimenten, die sich auf das Mikrobiom konzentrieren. Im Allgemeinen konzentrieren sich solche Studien auf die Klärung der Frage, welche Mikroben in einer bestimmten Probe vorhanden bzw. nicht vorhanden sind. Sie beantworten die allgemeine Frage „was ist da“ und „wie viele sind da“? Die verschiedenen Mikrobenarten in einem bestimmten Lebensraum (z. B. dem Darm) werden oft als Diversität einer Lebensgemeinschaft bezeichnet. Die Vielfalt der Lebewesen (z. B. Früchte oder Bakterien) in einem einzigen Lebensraum (z. B. Kot von Ferkel Nr. 495 am dritten Tag nach dem Absetzen) wird als Alpha-Diversität bezeichnet (Abb. 2) und berücksichtigt zwei Hauptaspekte:
- Artenreichtum: Wie viele verschiedene Bakterienarten gibt es?
-
Artengleichheit (Äquität): die Verteilung (Häufigkeit) dieser Arten, oder die Frage, ob ein Organismus vorherrscht (häufiger vorkommt als andere).
Es gibt viele Indizes zur Messung der Alpha-Diversität. Die gängigsten sind der Shannon-Index, der Chao-Index1 und der Simpsom-Index. Jeder von ihnen stellt verschiedene Aspekte der Alpha-Diversität dar. Diese Indizes werden häufig in Mikrobiomstudien verwendet und spiegeln die Diversität innerhalb einer Probe wider.




Abbildung 2: Interpretation von Messungen der mikrobiellen Diversität innerhalb von Proben (Alpha-Diversität). Die Diversität ist ein Produkt aus Artenvielfalt (z. B. Fruchtarten) und Äquität (z. B. Verteilung oder Häufigkeit jeder Fruchtart) in einer bestimmten Probe.
Wenn wir die Bakteriengemeinschaft zweier Lebensräume vergleichen (z. B. Kotproben von Schweinen, die mit Antibiotika behandelt wurden, und solche, die nicht behandelt wurden), untersuchen wir ihre Beta-Diversität, also die Ähnlichkeit zwischen den Proben. Haben diese Gemeinschaften viele Gemeinsamkeiten (finden wir z. B. dieselben Bakterien in Kotprobe A und B, Abb. 3)? Sind sie ähnlich oder unterschiedlich? Auch hierfür gibt es viele Indizes, wie z. B. UniFrac, den Jaccard-Index, die Bray-Curtis-Unähnlichkeit usw. Diese Indizes berücksichtigen verschiedene Aspekte der Diversität einer Lebensgemeinschaft, wie z. B. die (phylo)genetische Verwandtschaft zwischen den Mikroben oder ihre Häufigkeit in jeder Probe. Abbildung 3: Verständnis der Veränderungen in der mikrobiellen Zusammensetzung zwischen Proben (Beta-Diversität). Eine ähnlichere mikrobielle Gemeinschaft hat mehr Mikrobenarten zwischen den Proben gemein. In der Regel werden bei der Berechnung des Beta-Diversitätsindex auch andere Aspekte (wie genetische Verwandtschaft zwischen Mikroben) berücksichtigt.
Im Allgemeinen nimmt die mikrobielle Alpha-Diversität im Laufe des Lebens eines Schweins in seinem Darm zu und die Beta-Diversität nimmt ab (Abb. 4).
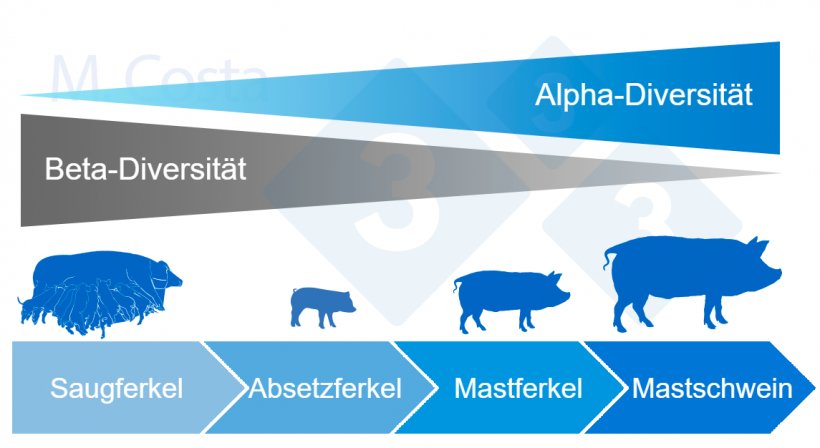
Abbildung 4: Dynamik der Alpha- und Beta-Diversität im Laufe des Lebens eines Schweins
Schritt 2 – Wurden in der Studie geeignete Kontrollen durchgeführt?
Bei Mikrobiomstudien sollten alle Anstrengungen unternommen werden, um die Auswirkungen von Verunreinigungen zu minimieren. Mikrobielle DNA ist buchstäblich überall (selbst wenn die Mikroben tot sind, ist ihre DNA noch vorhanden), und die derzeitigen DNA-Sequenzierungstechnologien können nur sehr geringe Mengen davon nachweisen (wie in Teil 1 erläutert). Daher müssen die Studien nicht nur die geeigneten Versuchsgruppen umfassen (z. B. Schweine derselben Partie, die entweder mit Antibiotika behandelt wurden oder nicht, die dasselbe Futter erhielten usw.), sondern auch die geeigneten technischen Kontrollen (leere Sammelröhrchen, Sequenzierungskits ohne Proben), um Verunreinigungen zu erkennen und aus den Analysen auszuschließen. Wenn diese in der Studie nicht offengelegt werden, könnten die Schlussfolgerungen fehlerhaft sein.

Schritt 3 – Biologische Signifikanz und jenseits des P-Wertes (oder: Hat dies die Tiere wirklich beeinflusst?)
Es ist relativ einfach, die Struktur einer mikrobiellen Gemeinschaft zu stören. Die Darmmikrobiota reagiert zum Beispiel empfindlich auf Veränderungen in der Ernährung, im Lebensraum und auf Antibiotika. Eingriffe können leicht zu bedeutenden Veränderungen in der Zusammensetzung der mikrobiellen Gemeinschaft (sowohl der Alpha- als auch der Beta-Diversität) führen. In den letzten Jahrzehnten wurden sehr wichtige Arbeiten durchgeführt, um dies zu bestätigen. Entscheidend ist jedoch der Nachweis der biologischen Bedeutung. Ein großer Teil der „Arbeit“, die Mikroben verrichten, ist überflüssig. So können beispielsweise viele Mitglieder der Darmmikrobiota die gleichen kurzkettigen Fettsäuren produzieren. Daher sind Veränderungen in der Zusammensetzung der mikrobiellen Gemeinschaft (oder „was da ist“) wahrscheinlich weniger wichtig als das, was sie tun. Es ist wichtig, nach indirekten Beweisen dafür zu suchen, dass letzteres durch die Intervention beeinflusst wurde, und das kann auf unterschiedliche Weise geschehen: mit der Wachstumsrate, der Widerstandsfähigkeit gegen Krankheiten oder der Darmbarrierefunktion. Dies hängt von der jeweiligen Studie ab, sollte aber benannt werden.
Wie bei jeder anderen Spitzentechnologie können einige wichtige Aspekte bei der Übertragung der Forschungsergebnisse vom Labor auf den Betrieb verloren gehen. In dem Maße, wie die Mikrobiom-Modulation und ihre Anwendungen in der Schweineproduktion klarer werden, sollten wir neue Strategien zur Steigerung der Leistung und der Widerstandsfähigkeit gegen Krankheiten sehen.





