Die Modellbildung wird zunehmend genutzt, um komplexe biologische Systeme und darin stattfindende Interaktionen zu analysieren. George E.P.Box hat dazu gesagt: "Im Grunde sind alle Modelle falsch, aber einige sind durchaus hilfreich". Damit beschreibt er den Hauptzweck von modellbasierten Studien: die Hauptprozesse und für die Studie interessante Sachverhalte komplexer Systeme können durch Vereinfachung von analysefähigen Teilsystemen erfasst und dargestellt werden. Die Modellbildung ist daher eine wichtige Ergänzung zu Beobachtungs- und dem experimentellen Studien, in denen unter Umständen neue wissenschaftliche Fragestellungen und Hypothesen entstehen können.
Durch epidemiologische Studien zu Risikofaktoren für das Post-Weaning Multisystemic Wasting Syndrome (PMWS) konnte die Infektionsdynamik bei heranwachsenden Schweinen eindeutig als zentraler Punkt ermittelt werden: je früher die Infektion stattfindet, je höher ist das Risiko. Änderungen bestimmter Managementpraktiken während der frühen Lebensphase der Ferkel wurden klar als Risikofaktoren für PMWS eingestuft und können die Übertragung von Pathogenen zwischen den Schweinen begünstigen. Vor dem Hintergrund einer möglichen vertikalen Übertragung von PCV2 und der Bedeutung der passiven Immunität, wird die Art und Weise des Ferkelversetzens verdächtigt, für eine gesteigerte PCV2 Übertragungsrate von infizierten auf empfängliche Würfe zu sein. Trotz dieser Erkenntnisse sind die Beziehung zwischen Risikofaktoren für PMWS und dem daraus resultierenden variablen Verlauf einer PCV2 Infektion noch nicht vollständig bekannt. Hier können Modellstudien wertvolle Informationen über derartige Interaktionen geben, indem das komplexe System der Populationsdynamik, das einem bestimmten infektiösen Prozess unterworfen ist, nachgebildet wird.

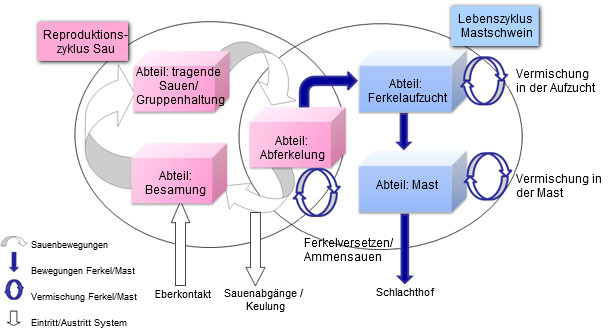
Grafik 1 : Populationsdynamik
Modellentwicklung
Das Modell zur Populationsdynamik wurde auf den Einzelfall bezogen erstellt (Grafik 1).Tatsächlich ließ sich mit Hilfe des durch eine hohe Repräsentativität gekennzeichneten Modells auf eine ausgeprägte Beziehung zwischen dem PCV2 Infektionsstatus tragender Sauen (und deren Nachkommen) sowie Einzeltierbewegungen schließen.
Darüber hinaus wurde das Modell auch unter stochastischen Gesichtspunkten konzipiert, um die biologische Variabilität der verschiedensten individuellen Parameter (Zahl der geborenen Ferkel/Wurf, Abortwahrscheinlichkeit, Mortalitätswahrscheinlichkeit...) mit einbeziehen zu können. Weiterhin wurde das Modell auf Basis des neuesten Standes der Wissenschaft zum Infektionsverlauf von PCV2 innerhalb des Wirtes designed (Grafik 2). Die Kernkomponente war ein SEIR-Modell (engl für: empfänglich-ungeschützt-infektiös-genesen/resistent). Trotzdem wurden die verschiedenen Infektionstatus berücksichtigt, um die vertikale und die pseudovertikale Transmission sowie die Bedeutung maternaler Antikörper abbilden zu können. Um den PCV2 Infektionsverlauf realistisch darstellen zu können, wurden Übertragungsversuche durchgeführt.
Diese Experimente (Bild 1) basierten auf Kontakten zwischen infizierten und empfänglichen Tieren und der sequentiellen Überwachung von infizierten Tieren und Sentineltieren. Dadurch konnte aufgrund der verschiedenen Kontaktmuster zwischen den Einzeltieren auf Parameter der Übertragung geschlossen werden. Darüber hinaus wurde festgestellt, dass die Übertragungsrate variabel ist, mit einem Peak um den 15. Tag post infectionem. Danach nimmt die Übertragungsrate bis zum 49. Tag p.i. ab. Mit einem ähnlichen Studienprotokoll durchgeführte Versuche konnten zeigen, dass es in einer geimpften Population zu signifikanten Reduktion der Übertragungsrate kommt. Das letzte Modell entstand aus der Verbindung des Modells zur Populationsdynamik und den epidemiologischen Modellen.
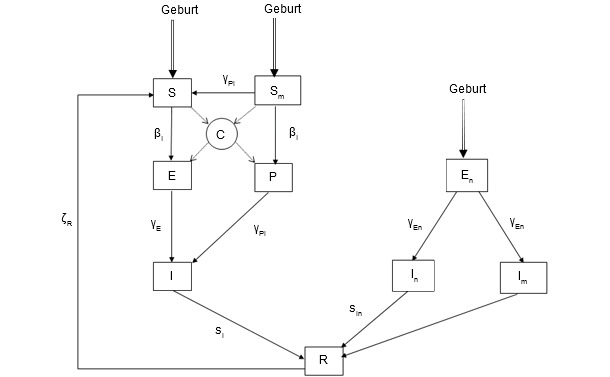
Grafik 2.Das epidemiologische Modell der PCV2 Infektion. Variablen: S:empfänglich; Sm: bei Geburt empfängliche Ferkel mit passiver Immunität; E:Latenzzeit für Schweine mit passiver Immunität; P:Ferkel, die durch Kontakt mit infiziertem Individuum ebenfalls infiziert wurden, obwohl passive Immunität bestand; I: infektiöse Schweine; En: Ferkel, die mittels infiziertem Sperma pseudovertikal infiziert wurden; In: Infizierte Ferkel (pseudovertikal infiziert) ohne passive Immunität; Im: Infizierte Ferkel (pseudovertikal infiziert) mit passiver Immunität R: genesene Ferkel, die nicht mehr infektiös sind.

Bild 1:Übertragungsversuche, um Transmissionsparameter bestimmen zu können
Schlussfolgerungen aus den Modellen
Als Ausgangsgröße wurde das Alter zum Infektionszeitpunkt, einem Hauptrisikofaktor für PMWS, betrachtet. Zwölf Kombinationen aus Managementstrategien im Rahmen der Betriebsführung (Ferkelversetzen und Haltungspraktiken in der Ferkelaufzucht) wurden zum Infektionsalter in Bezug gesetzt. Indem das Umsetzen von Ferkeln im Abferkelbereich und in der Ferkelaufzucht minimiert wurde, konnte der Infektionszeitpunkt herausgezögert und die Rate der frühen Infektionen reduziert werden. Durch Bündeln von Ferkeln in kleine Gruppen nach dem Absetzen konnte eine weitere signifikante Reduktion der Wahrscheinlichkeit einer frühen Infektion erreicht werden. Mit Hilfe dieser Ergebnisse konnten mögliche Interaktionen zwischen den verschiedenen PMWS-Risikofaktoren bestimmt werden.
Für zwei extreme Formen des Betriebsmanagements wurden die altersspezifischen Seroprävalenzen aufgezeichnet. Zum einen wurde die liberalste Form betrachtet (zufälliges Versetzten von Ferkeln sowohl im Abferkel- als auch im Aufzuchtbereich mit große Buchten in der Ferkelaufzucht), zum anderen die restriktivste (kein Ferkelversetzen im Abferkelbereich und wurfweise Aufstallung in kleinen Gruppen in der Ferkelaufzucht. Die Ergebnisse wurden mit Seroprävalenzdaten aus einer Feldstudie verglichen (Grafik 3). Die in der Simulation ermittelte Seroprävalenz bei liberalen Managementpraktiken war vergleichbar mit Seroprävalenzen in Betrieben mit klinischen PMWS-Fällen, dagegen war das unter restriktiven Managementpraktiken ermittelte Seroprävalenzmuster vergleichbar mit dem in subklinisch infizierten Betrieben (Grafik 3).
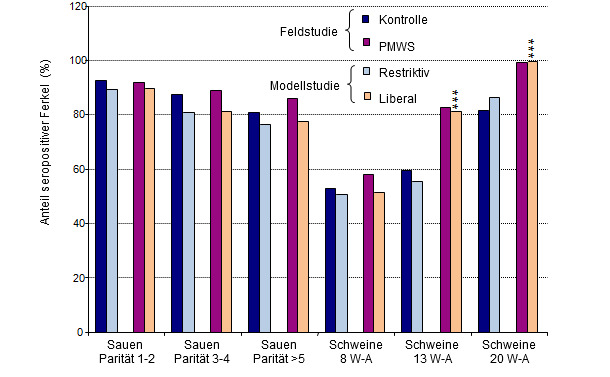
Grafik 3: Vergleich der Ergebnisse von Feldstudie vs. Modellstudie
Bei der Evaluierung verschiedener Impfstrategien zeigte die Simulation, dass die Ferkelimpfung die Infektionsrate massiv senkt. Damit kann auf einem starken Schutzeffekt der Ferkelimpfung geschlossen werden, was zu einer bedeutenden Abnahme der PCV2- Infektionen in der Ferkelaufzucht und der Mast führt.
Mit Hilfe dieser Ergebnisse kann die häufig berichtete hohe Wirksamkeit der PCV2- Impfungen gegenüber PMWS erklärt werden, indem mit der Reduktion der Infektionsrate im Ferkelalter die Hauptursache für den klinischen Ausbruch unter Kontrolle ist.
Mit Hilfe dieses Beispiels konnte aufgezeigt werden, wie der modellbasierte Ansatz einen wertvollen Beitrag zum Verständnis komplexer Erkrankungen leisten kann, die im Rahmen eines speziellen Infektionverlaufs durch ein Pathogen verursacht werden. Vorausgesetzt das Modell wurde fachgerecht designed und die zu betrachtenden Parameter wurden sorgfältig gewählt, sind Modellstudien für das Verständnis biologischer Abläufe, zur Evaluation verschiedener Szenarien und zur Anregung neuer wissenschaftlicher Fragestellungen sehr hilfreich.



