Der Betrieb
Der klinische Fall ereignete sich auf einem Betrieb mit 250 Sauen in der polnischen Region in Wielkopolska. Es handelt sich dabei um einen Vermehrerbestand, bei dem potentielle Jungsauen bis zu einem Körpergewicht von etwa 100 kg gehalten werden. Die männlichen Absetzferkel und die nicht für die Zucht ausgewählten weiblichen Tiere werden an einen Mäster verkauft. Der Betrieb wirtschaftet im Wochenrhythmus mit ca. 10 Sauen in den Produktionsgruppen. Die Sauen werden ausschließlich künstlich besamt. Das Absetzalter für die Ferkel beträgt 28 Tage. Pro Jahr werden etwa 6200 Absetzer aufgezogen. Die Belegung der Auszuchtställe erfolgt dabei nach dem Rein-Raus-Prinzip. Die Umgebungsbedingungen in der Aufzucht lassen sich als gut beschreiben und auch der Gesundheitszustand des Betriebes ist als sehr gut zu bewerten. Der Bestand ist frei von Brachyspira hyodysenteriae, Salmonella spp., Pasteurella multocida (Rhinitis atrophicans), PRRSV, Actinobacillus pleuropneumoniae, Mycoplasma hyopneumoniae und Leptospira spp. Nur im Hinblick auf Bordetella bronchiseptica und Lawsonia intracellularis ist der Betrieb positiv. Fälle von PMWS sind noch nicht beobachtet worden. Die Impfprophylaxe im Zuchtbestand umfasst eine Muttertierschutzimpfung gegen E.coli (Jungsauen 8 und 3 Wochen vor der Abferkelung, Altsauen 3 Wochen vor der Abferkelung), sowie eine Impfung gegen Rotlauf und Parvovirose (Jungsauen mit 5,5 und 6,5 Monaten, Altsauen 3 Wochen vor der Abferkelung). Es wird keine Impfung gegen PCV2 durchgeführt.

Der klinische Fall
Während des ersten Bestandsbesuchs fielen plötzliche Todesfälle von Tieren auf, die zuvor keine Krankheitsanzeichen zeigten. Dabei wurden hochgradige Ödeme am Kopf, an den Ohren, sowie an der Brust (Abb. 1) und ein Anstieg der Körpertemperatur auf 41,5°C bei diesen Schweinen beobachtet. Nur in Einzelfällen zeigten betroffene Tiere neurologische Symptome (Opistothonus, Seitenlage, Ruderbewegungen der Gliedmaßen). Zunächst beschränkten sich die Symptome auf die Gruppe der Jungsauen mit einem Gewicht von 70-100 kg. Die Morbidität stieg auf 15% und die Mortalitätsrate auf 6% an. Im folgenden Monat wurden ähnliche Symptome mit einer etwas geringeren Intensität auch bei jüngeren Tieren (Absetzferkel, Läufer und Jungsauen bis 70 kg) beobachtet. Innerhalb der nächsten Wochen traten ähnliche Krankheitserscheinungen (mit Ausnahme der neurologischen Symptome) bei den abgesetzten Sauen und in den Abferkelabteilen bei den Saugferkeln auf.
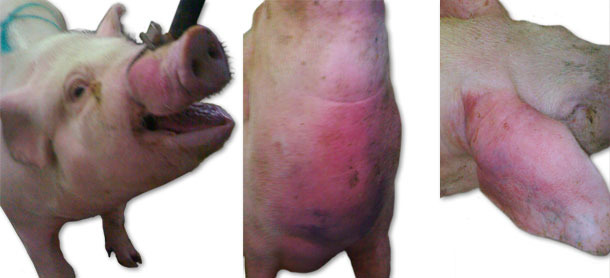
Abb. 1. Ödeme am Kopf, an der Brust und an den Ohren
Diagnostik
Vier kranke Schweine mit hochgradigen Ödemen und Körpertemperaturen von 41,0 bis 41,3 °C wurden zur Sektion in ein Diagnostiklabor gebracht. Bei der Sektion wurden subkutane, gallertartige Infiltrationen besonders in den Bereichen der unteren Körperteile beobachtet (Abb. 2, 3), sowie eine serofibrinöse Perikarditis (Abb. 4) und Pleuritis festgestellt. Zwei Absetzferkel zeigten außerdem eine subkutane Flüssigkeitsansammlung im Bereich des Sternums (Abb. 3).
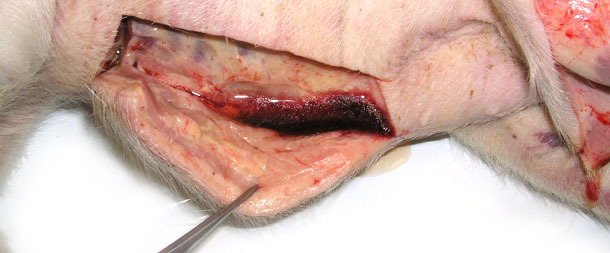
Abb. 2. Schwellung des subkutanen Bindegewebes. Nach Anschnitt der Haut trat eine große Menge Flüssigkeit besonders in den Bereichen der unteren Körperteile aus.
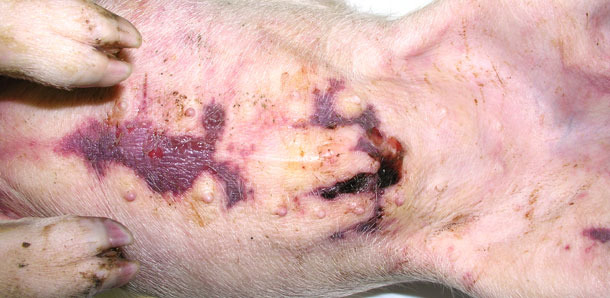
Abb. 3. Ansammlung von Flüssigkeit unter der Haut im Bereich des Sternums.
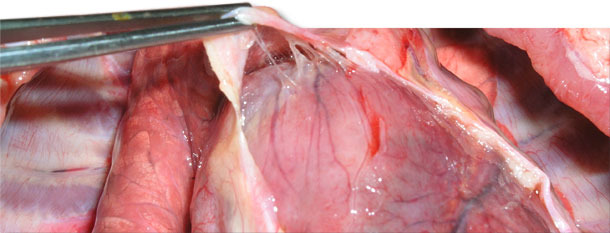
Abb. 4. Leichte Fibrinfäden zwischen Epi- und Perikard.

Nach der pathologischen Befunderhebung wurden bakteriologische Untersuchungen eingeleitet. Das Untersuchungsmaterial wurde unter aseptischen Bedingungen gewonnen und die Tupfer wurden kurz nach Eröffnung der Körperhöhlen genommen. Da keine Lahmheit oder zentralnervöse Störungen bei den zu untersuchenden Tieren festgestellt wurden, wurden auch keine Gelenkstupfer und keine Cerebrospinalflüssigkeit (Liquor) weiter untersucht.
Das Untersuchungsmaterial wurde auf Blutagarplatten mit einer Ammenkultur von Staphylococcus epidermidis und auf McConkey Agar ausgestrichen. Die Identifikation der Bakterienkolonien wurde mithilfe von biochemischen (Vitec) oder molekularbiologischen Tests (PCR) durchgeführt.
Laborergebnisse
Bei der bakteriologischen Untersuchung wurde ein Wachstum von Haemophilus parasuis (H. parasuis) beobachtet. Die Kolonien waren sehr klein, nicht hämolysierend, sowie mit Satellitenwachstum (Vergrößerung der Koloniegröße) in direkter Nähe der Amme Staphylococcus epidermidis und somit bei Bereitstellung des Wachstumsfaktors NAD.
Die Tupfer, die von pathologisch-veränderten Geweben von den vier Absetzferkeln genommen wurden, wurden zusätzlich direkt mittels PCR untersucht. Die Ergebnisse sind in der folgenden Tabelle dargestellt.
Tabelle I. Diagnose von Haemophilus parasuis auf den serösen Häuten und im Serum.
| Gewebe | Absetzer 1 | Absetzer 2 | Absetzer 3 | Absetzer 4 |
| Kulturelle Isolierung + PCR / direkte PCR aus Gewebematerial | ||||
| Pleura | +/+ | +/+ | +/+ | +/+ |
| Pericardium | +/+ | +/+ | +/+ | +/+ |
| Peritoneum | -/- | +/+ | -/- | -/- |
| Serum | +/+ | -/- | -/- | -/+ |
Mit diesen Ergebnissen konnte das Vorkommen von H. parasuis auf verändertem Material nachgewiesen werden, was typisch für die Glässersche Krankheit ist. Das Bakterium bzw. die bakterielle DNA (PCR) konnte zusätzlich im Serum nachgewiesen werden, was zeigt, dass zwei der vier untersuchten Tiere eine Bakteriämie hatten.
Nachdem H. parasuis bei den vier sezierten Absetzern gefunden wurde, wurden außerdem 20 Nasentupfer von weiteren Absetzferkeln, Jungsauen und Sauen genommen, um die Stämme von kranken und gesunden (sog. Carriern) Tieren vergleichen zu können. Die Nasentupfer wurden ebenfalls mikrobiologisch und molekularbiologisch untersucht (biochemische Identifikation und eindeutige Bestätigung des Stammes mittels PCR).
10 H. parasuis Isolate aus dem Bestand - vier von den sezierten Absetzern und sechs weitere Isolate von gesunden Tieren - wurden mithilfe der ERIC PCR-Bestimmungsmethode analysiert (Abb. 5). Alle Isolate, die von den erkrankten Tieren stammten, zeigten identische ERIC PCR Profile. Interessanterweise wurden identische Stämme auch auf den Nasentupfern von zwei der sechs gesunden Tiere gefunden. Von den übrigen vier Schweinen wurden unterschiedliche Stämme von H. parasuis auf der Nasenschleimhaut isoliert, die auch durch unterschiedliche ERIC PCR Profile charakterisiert wurden.
 Abb. 5. Dendrogramm - Vergleichende Darstellung von H. parasuis Stämmen, die auf dem Betrieb isoliert und mittels ERIC PCR analysiert wurden.
Abb. 5. Dendrogramm - Vergleichende Darstellung von H. parasuis Stämmen, die auf dem Betrieb isoliert und mittels ERIC PCR analysiert wurden.
Behandlung
Die Tiere, die klinische Symptome zeigten, wurden mit Amoxicillin und Clavulansäure behandelt (Injektion i.m.). Die übrigen Tiere erhielten eine metaphylaktische Behandlung mit Amoxicillin (über das Trinkwasser, 14 Tage, 20 mg/kg KG). Diese Behandlung führte zu einem dauerhaften Therapieerfolg.
Schlussfolgerung
In Beständen mit sehr hohem Gesundheitsstatus zeigt sich die H. parasuis Infektion oftmals in seiner akuten Form. Tiere aller Altersgruppen sind dabei empfänglich für die Infektion. Krankheitserscheinungen wie Fieber, Apathie, Atembeschwerden, zu beobachtender Schmerz nach Druck auf das Abdomen, geschwollene Gelenke und Lahmheit sind typisch für die Glässersche Krankheit. Zentralnervöse Störungen und subkutane Ödeme, wie im vorliegenden Fall beschrieben, wurden außerdem bei diesem Krankheitsbild beschrieben.
Die krankhaften Veränderungen, die im beschriebenen akuten Krankheitsfall auftraten, sind typisch für eine akute serofibrinöse Entzündung. Allerdings sind solche Veränderungen nicht pathognomonisch, sodass die Diagnose nur durch weiterführende Labordiagnostik erfolgen kann.
Die bestimmte Lokalisation der Ödeme (Bereich der unteren Körperteile) und deren Charakter könnten darauf schließen lassen, dass die Ödeme auf ein Herzversagen (kardiales Ödem), genauer auf eine Herzinsuffizienz mit folgendem Blutstau in den großen Körperkreislauf, zurückzuführen sind. Allerdings passt diese Aussage im vorliegenden Fall nicht eindeutig, da hier H. parasuis direkt im subkutanen Gewebe nachgewiesen wurde. Und somit könnte die anschwellende Entzündung hier direkt auf das bakterielle Agens zurückzuführen sein. Diese Tatsache könnte mit dem Auftreten einer Bakteriämie erklärt werden, bei der die Bakterien über geschädigte Blutgefäße in das subkutane Gewebe gelangt sein könnten.
Die Möglichkeit der Unterscheidung zwischen verschiedenen Stämmen von H. parasuis, die innerhalb eines Bestandes vorkommen können, kann bedeutsam sein, da die Epidemiologie von H. parasuis komplex ist und die durch diesen Mikroorganismus ausgelöste Infektion einem dynamischen Prozess unterliegt. Deshalb wird oftmals eine Typisierungstechnik beim Nachweis von H. parasuis angewendet, mit welcher Stämme innerhalb der Spezies identifiziert werden können (ERIC PCR). Besonders in Beständen mit hohem Gesundheitsstatus dominieren bestimmte Stämme oder gibt es einen Stamm, der eine Krankheit auslösen kann. Deshalb ist die Möglichkeit der Unterscheidung zwischen verschiedenen Stämmen von H. parasuis gerade auf Bestandsebene so bedeutend. Im vorliegenden Fall konnte gezeigt werden, dass sechs Isolate identische ERIC PCR Profile aufwiesen und zu einem pathogenen Stamm von H. parasuis gehörten. Dessen Vorkommen konnte außerdem bei klinisch unauffälligen Tieren bestätigt werden. Der oben erwähnte dauerhafte Therapieerfolg durch die antibiotische Behandlung (ohne anschließende Impfung) lässt sich eventuell auch damit erklären, dass innerhalb des Bestandes eine Immunität aufgebaut wurde, die vor einem klinischen Ausbruch durch den zuvor pathogenen H. parasuis Stamm schützt.