Die Immunantwort auf eine Infektion durch PRRSV Typ 1 und Typ 2 hat ähnliche Folgen. Das heißt, es werden antigenspezifische humorale und zellvermittelte Reaktionen hervorgerufen, es werden Antikörper für eine Reihe viraler Proteine produziert, die Infektion klingt ab und eine Gedächtnisantwort wird hervorgerufen, die vor künftigen Infektionen schützt. Die Reaktionen auf die zwei verschiedenen viralen Genotypfamilien unterscheiden sich jedoch quantitativ in einigen wichtigen Punkten. Sowohl die Schwere der Infektion als auch die Stärke der Immunantwort sind bei PRRSV-Infektionen Typ 1 im Vergleich zu PRRSV-Infektionen Typ 2 reduziert. Folglich ist die Untersuchung des Immunschutzes gegen Reinfektionen beim Infektionsmodell Typ 1 schwierig, da die Krankheit wiederholbar möglicherweise schwer nachzuweisen ist und die Infektion auftreten kann, ohne dabei zu Krankheitssymptomen zu führen. Interpretationen können somit ohne verlässliche positive und negative Kontrolle mit reproduzierbaren Endpunkten irreführend sein. Aufgrund dieses Problems beruhen die meisten Untersuchungen zu schützender Immunität und zur Impfung auf PRRSV Typ 2, bei dem die klinische Erkrankung sowohl bei respiratorischen als auch bei reproduktiven Fällen von PRRSV-Infektionen wiederholbar belegt werden kann. Diese Einschränkung ist von Bedeutung, da PRRSV Typ 1 der in Europa vorherrschende Virustyp ist, während PRRS in Asien und Nordamerika vor allem durch Viren des Typs 2 hervorgerufen wird.

Die Kinetik von Antikörperreaktionen auf Infektionen durch PRRSV Typ 2.

Abbildung 1: Die Kinetik von Antikörperreaktionen auf Infektionen durch PRRSV Typ 2 zeigt, dass die Reaktion auf einzelne PRRSV-Proteine derjenigen auf das Schlitzschnecken-Hämocyanin (KLH), einem unverwandten Proteinantigen, gleicht (geändert von Mulupuri et al. 2008. J. Virol. 82:358-370).
Bei der erstmaligen Infektion immunologisch naiver Schweine mit PRRSV erfolgt eine angeborene Immunantwort mit Anzeichen einer Interferoninduktion durch virulente Viren. Allerdings gibt es kein Interferon bei Infektionen mit niedrig virulenten Viren. Einige virale Proteine blockieren die angeborene Interferonantwort, aber unabhängig von der Effektivität der angeborenen Immunität bei der Bekämpfung von PRRSV-Infektionen wurde eine normale humorale Immunantwort beobachtet. Dies umfasst die schnelle Produktion von IgM-Antikörpern gegen eine Reihe viraler Proteine mit anschließendem Klassenwechsel zu IgG-Antikörpern gegen dieselben Proteine. Die Reaktionskinetik ist mit der Reaktion auf ein nicht infektiöses Kontroll-Proteinantigen identisch. PRRSV-spezifische Antikörper, die Plasmazellen und B-Gedächtniszellen sezernieren, kommen vor allem in der Milz und dem Lymphgewebe vor, das die Lunge und die Fortpflanzungsorgane drainiert. Die Mandeln sind der primäre Ort von B-Gedächtniszellen. Neutralisierende Antikörper treten später bei Infektionen in niedriger Konzentration zum Ende der Virämie auf.
Die Induktion von B- und T-Gedächtniszellen ist ebenso wie die wesentlichen Merkmale der schützenden Immunität von entscheidender Bedeutung für den virusspezifischen Schutz vor einer künftigen Infektion. PRRSV-spezifische Gedächtniszellen können leicht produziert werden und reagieren auf verschiedene virale Proteine in Zellkultur. Die Provokation von immunen Schweinen führt jedoch nicht zu einer klassischen anamnestischen Reaktion. Der Status der Immunabwehr kann somit nicht durch Untersuchung der serologischen Reaktion nach einer Provokation vorhergesagt werden. Die Schutzwirkung ist dagegen eher durch virologische und klinische Auswirkungen zu bestimmen, die auf die Reduzierung oder Unterbindung der Infektion und Krankheit hinweisen. Infektionsversuche zeigen regelmäßig, dass die Immunität, die durch Lebendimpfstoffe und virulente Viren induziert wurde, zu einem umfassenden Schutz vor künftigen Infektionen durch unverwandte Viren führt. Die konservierten antigenen Epitope, die für den heterologen Schutz maßgeblich sind, wurden noch nicht identifiziert.
In Versuchen wurde zwar von verschiedenen immunpathologischen Folgen von PRRSV-Infektionen, einschließlich Hypergammaglobulinämie und der infektionsverstärkenden Antikörper der Infektion, berichtet, aber es fehlt an Beweisen für deren Auftreten in der Praxis. Dagegen sind immunosuppressive Wirkungen einer viralen Infektion in Versuchen schwer zu reproduzieren. In der Praxis bestehen allerdings kaum Zweifel daran, dass sich die Gesundheit des gesamten Bestands nach einem PRRS-Ausbruch verschlechtert.
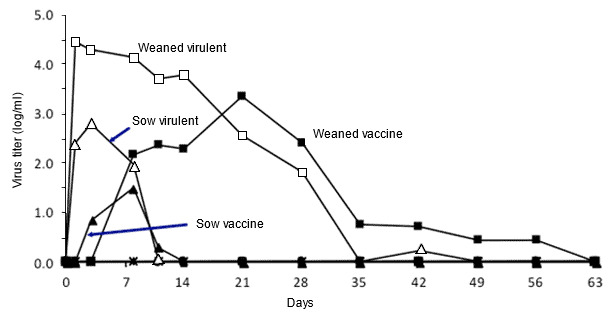
Wirkung des Alters der Schweine auf die Zunahme von PRRSV.
Abbildung 2: Wirkung des Alters der Schweine auf die Zunahme von PRRSV. Quantitative Virämiegrade im Laufe der Zeit bei abgesetzten Ferkeln und adulten Sauen, die einem virulenten oder attenuierten PRRSV Typ 2 ausgesetzt wurden (nach Klinge et al. 2009. Virol J. 6:177-187).
Ein Kennzeichen von PRRS ist die große Variabilität sowohl beim Virus als auch bei der Reaktion des Schweins auf das Virus. PRRSV Typ 1 und Typ 2 sind genetisch verschieden und auch innerhalb jeder Gruppe gibt es sehr starke Abweichungen. Die Wechselwirkungen von PRRSV mit den Schweinen zu verstehen ist aufgrund der Tatsache kompliziert, dass die meisten Forschungsarbeiten nur mit wenigen Virusisolaten durchgeführt werden, von denen viele für die Isolate, die derzeit zu Erkrankungen führen, nicht repräsentativ sind. Außerdem gibt es enorme Unterschiede bei der Reaktion von immunologisch naiven Schweinen auf Primärinfektionen oder der Reaktion von immunen Schweinen auf Infektionen mit dem Feldvirus. Mastschweine und adulte Sauen haben beispielsweise eine höhere angeborene Resistenz gegenüber Infektionen als abgesetzte Ferkel, obwohl die durch eine Infektion bedingte Immunantwort in allen Altersgruppen anscheinend gleich ist. Die Klärung der Gründe für die Unterschiede bei den Viren und Wirten macht die Identifizierung und Charakterisierung der entscheidenden B- und T-Zellepitope, die in verschiedenen PRRS-Viren enthalten sind, sowie der molekularen und strukturellen Details der wichtigen Effektor-Antikörper, der T-Zell-Antigenrezeptoren und der MHC-Moleküle erforderlich, die zu einer umfassenden Kreuzimmunität führen.