Der Krankheitsverlauf und die Läsionen, die durch PRRSV-Infektionen verursacht werden, hängen überwiegend von den allgemeinen Eigenschaften der Viren ab, die zur Gattung Arterivirus gehören: (i) die Fähigkeit in die primäre Zielzelle, die Makrophage, zu gelangen und sich dort zu vermehren; (ii) lang dauernde Virämie nach der Infektion; und (iii) lang anhaltende (nicht permanente!) Infektion im Tier. Die akute Phase der Virämie bei Mastschweinen dauert ca. 4 Wochen, nach denen das Virus normalerweise für den Rest des Lebens eines Nutztiers in erster Linie im Lymphgewebe zu finden ist. Dabei kann die Virämie in regelmäßigen Abständen wieder auftreten (ausführlich behandelt in Chand et al. 2012, Curr Opin Virol).
Im Lungengewebe können sich Läsionen, die durch respiratorische Viren hervorgerufen wurden, über die folgenden zwei wichtigsten Wege entwickeln: die unmittelbare Zerstörung und Dysregulation der Pneumozyten und/oder die Infektion der Entzündungs- und Immunzellen, die durch die Freisetzung aktiver Zytokine und schädlicher Metaboliten zu Gewebeschäden führen. Diese aktivierten Zellen können andere Entzündungszellen zum Ort der Infektion rekrutieren, die zwar Gewebeschäden vergrößern können, denen aber auch eine wichtige Rolle bei der viralen Clearance und der Regulation der Entzündung zukommt.

Im Falle von PRRSV-Infektionen ist die primäre Zielzelle die Alveolarmakrophage. Gewebeschäden sind die Folge direkter Apoptose (und Nekrose) dieser Zellen und in größerem Umfang ihrer Nachbarzellen (Bystander) aufgrund der Freisetzung von apoptogenen Zytokinen, reaktiven Sauerstoffspezies und Stickstoffmonoxid. Zur selben Zeit werden auch proinflammatorische Zytokine ausgeschüttet, die für die Rekrutierung anderer Entzündungszellen verantwortlich sind, wobei einige von ihnen zu den systemischen Symptomen (Fieber, Lethargie etc.) führen. Außerdem werden antiinflammatorische, regulatorische Zytokine ausgeschieden. Ebenso gut ist dokumentiert, dass PRRSV ähnlich wie andere Viren die Fähigkeit besitzt, die primäre Alpha-Interferon-Antwort – einen starken antiviralen Mechanismus der angeborenen Immunität – in frühen Phasen der Infektion durch seine Nichtstrukturproteine zu unterdrücken, wodurch es ihm möglich wird, sich effizienter zu vermehren und zu verbreiten. Verschiedene PRRSV-Isolate besitzen jedoch unterschiedliche immunmodulatorische Fähigkeiten und die klinischen Symptome, die Schädigungen und der gesamte Ausgang der Infektion hängen überwiegend von dem verschobenen Gleichgewicht des oben genannten Mechanismus ab. Wie unter Feldbedingungen häufig zu beobachten ist, kann die Schädigung bzw. die Zerstörung der Makrophagen Sekundärinfektionen hervorrufen.
Im Falle experimenteller Infektionen, die in isolierten Einrichtungen erfolgten, hängen die klinischen Symptome und die festgestellten Schädigungen überwiegend von der Pathogenität des für die Verimpfung der Tiere benutzten Stamms ab. Die schwersten respiratorischen Erkrankungen können zwischen 7–14 Tage nach der Infektion (p. i.) beobachtet werden. Makroskopisch erkennbar sind feste, braune, gefleckte Bereiche, die in stärkerem Maße die kranioventralen Lungenlappen betreffen, aber ebenso auch über das gesamte Lungengewebe verstreut auftreten können (Bild 1). Zu den wichtigsten histopathologischen Läsionen zählen: (1) Hypertrophie und Hyperplasie der Pneumozyten; (2) septale mononukleäre Infiltration, (3) intraalveolärer nekrotischer Debris, (4) intraalveoläre Akkumulation von Entzündungszellen und (5) perivaskuläre Akkumulation von Entzündungszellen.
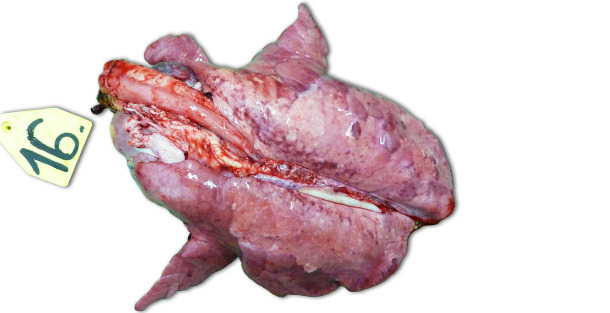
Abbildung 1: Lunge eines Ferkels, das 14 Tage p. i. gekeult wurde und mit dem hochpathogenen Typ I Subtyp 3 Stamm „Lena” inokuliert worden war.
In einer Challenge-Studie, in der Schweine 14 und 21 Tage p. i. gekeult wurden, war bei den infizierten Schweinen 21 Tage p. i. ein deutlicher Rückgang der intraalveolären nekrotischen Debris und der intraalveolären Entzündungszellen zu beobachten, während bezüglich der drei anderen Kategorien nur geringe Änderungen verzeichnet wurden. Diese Ergebnisse sind durch die Tatsache zu erklären, dass die Entstehung intraalveolärer nekrotischer Debris und die folgende Akkumulation intraalveolärer Entzündungszellen (hauptsächlich neutrophiler Granulozyten) die akute Phase der Erkrankung widerspiegelt (Abbildung 2), in der die Freisetzung schädlicher Stoffe durch die mit dem Virus infizierten Makrophagen zu ausgedehnten Schädigungen des Lungengewebes führen. Nach der akuten Anfangsphase der Erkrankung und, wenn keine sekundäre bakterielle Infektion vorliegt, sorgen das Immunsystem und der natürliche Heilungsprozess dafür, dass das nekrotische Gewebe entfernt wird. Die Zellen der akuten Entzündung (neutrophile Granulozyten) verschwinden, die Alveolen werden entleert und die beschädigten Pneumozyten werden durch die sich vermehrenden Pneumozyten Typ II ersetzt.
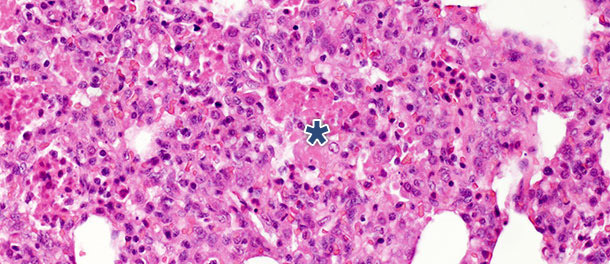
Abbildung 2: Intraalveolärer nekrotischer Debris und Akkumulation von Entzündungszellen (Sternchen) im Lungengewebe 10 Tage p. i. mit PRRSV Typ 1 Subtyp 1 Isolat. H.E. 200×
Pneumozyten Typ II sind kubische Zellen, die sich normalerweise an den Alveolarsepten befinden. Beim Lungengewebe von Säugetieren machen sie 60% aller alveolaren Epithelzellen aus, bedecken aber nur ca. 5% der alveolaren Oberfläche. Ihre wichtigste Funktion besteht in der Synthese, Sekretion und der Wiederaufnahme von Surfactant, das die Oberflächenspannung in den Alveolen reduziert und so deren Kollabieren beim Ausatmen verhindert. Die andere wichtige Funktion der Pneumozyten Typ II liegt in ihrem proliferativen Potential. Nach einer Schädigung der Pneumozyten Typ I dienen die Pneumozyten Typ II als Progenitorzellen zum Ersatz der zuvor geschädigten und abgeschuppten Pneumozyten Typ I, zu denen sie sich gelegentlich auch differenzieren. In der oben beschriebenen Challenge-Studie stieg die Anzahl dieser Zellen 10 Tage p. i. deutlich an (Bild 3) und verringerte sich 21 Tage p. i. nicht. Obwohl die Studie 21 Tage nach der Infektion beendet wurde und in der infizierten Gruppe keine vollständige Ausheilung der Krankheit (restitutio ad integrum) festgestellt wurde, überwanden die Tiere die klinische Erkrankung. Die erhöhte Zahl an Pneumozyten Typ II nach der Impfung sowohl in den frühen als auch den späten Stadien der Krankheit zeigt ihre Bedeutung bei der Heilung des Lungengewebes (ausführlich erörtert in Balka et al. 2013. J Comp Pathol).
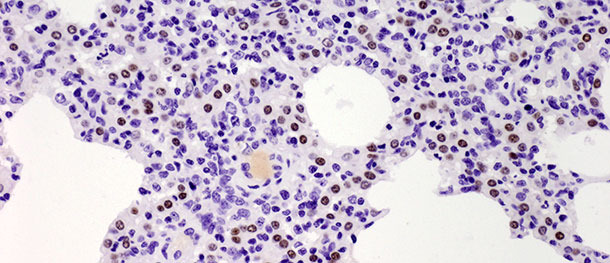
Abbildung 3: Braune Flecken zeigen die Kerne der Pneumozyten Typ II, die mit Anti-TTF-1 Antikörpern identifiziert wurden. 10 Tage p. i. mit einem Typ I Subtyp 1 Isolat wurde ein deutlicher Anstieg der Zahl positiver Zellen festgestellt. IHC 200×








