1. Einleitung
Seit seiner Entdeckung im Jahr 1991 verursacht das Porcine Reproduktive und Respiratorische Syndrom-Virus (PRRSV) der Schweineindustrie weltweit große wirtschaftliche Probleme. Die Infektion mit PRRSV von Sauen und Jungsauen kann subklinisch verlaufen, aber auch schwere Reproduktionsstörungen und sogar den Tod des Muttertieres nach sich ziehen. Häufig kommt es vermehrt zu Aborten, lebensschwach geborenen Ferkeln, mumifizierten Feten und zu geringen Wurfgrößen. Bei Läufern kann PRRS einen subklinischen oder schweren Verlauf nehmen. In der Regel manifestiert sich die Infektion als Atemwegserkrankung und mit verminderten Gewichtszunahmen. Das PRRS-Virus zielt bei Schweinen dieser Altersgruppe vorwiegend auf die Atemwege und das Immunsystem ab. Das Virus vermehrt sich in den Lungenmakrophagen sowie in verschiedenen Zellen des lymphatischen Systems. Die Lungenmakrophagen stellen die erste Verteidigungslinie im Atemtrakt dar. Sind Lunge und Immunsystem erst einmal durch PRRSV geschädigt oder verändert, werden die Schweine empfänglicher für andere respiratorische und septikämische Pathogene.

2. Arten des PRRS-Virus
Die wichtigsten derzeit bekannten PRRSV-Genotypen sind in Abb. 1 zusammengefasst. Generell werden Typ-2-Isolate als virulenter als Typ-1-Isolate angesehen.
| Typ 1 | Typ 2 |
| Synonym: Europäischer PRRSV-Genotyp |
Synonym: Nordamerikanischer PRRSV-Genotyp |
| Prototyp: Lelystad virus |
Prototyp: VR2332 Atypisches PRRSV: (1998) Hoch pathogenes (HP) PRRSV: Begrenzt auf China, (2006) |
Abb. 1 Die wichtigsten derzeit bekannten PRRSV-Genotypen
3. PRRSV und der Porcine Respiratorische Krankheitskomplex (PRDC)
Der Begriff „Porciner Respiratorischer Krankheitskomplex“ (engl. porcine respiratory disease complex/PRDC) wird allgemein verwendet, um eine Erkrankung zu beschreiben, die durch die Interaktion von multiplen respiratorischen Pathogenen (viral und bakteriell), Umweltfaktoren, Art des Produktionssystems und des Managements sowie schweinespezifischen Faktoren (Genetik, Alter, immunologischer Status) verursacht wird. Das PRRS-Virus wird dabei als das primäre und wahrscheinlich wichtigste für die Entstehung des PRDC verantwortliche Pathogen angesehen (Abb. 2).
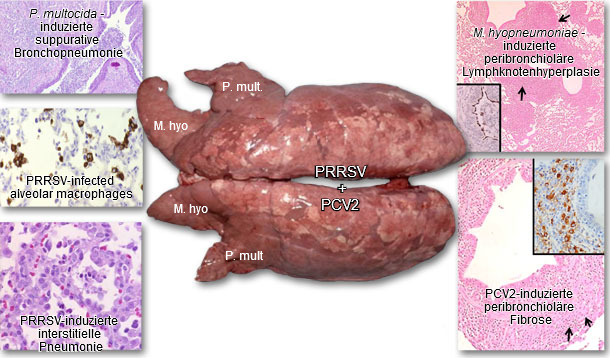
Lunge eines an PRDC leidenden Schweines
Abb. 2 Lunge eines an PRDC leidenden Schweines. Diagnostiziert wurde eine konkomitierende Infektion mit PRRSV, PCV2, M. hyopneumoniae und P. multocida Typ A. Bildtexte: Immunhistochemische Färbung auf M. hyopneumoniae, PCV2 und PRRSV. Braun gefärbte Stellen zeigen die Anwesenheit von Antigen. Bilder freundlicherweise zur Verfügung gestellt von Dr. Patrick G. Halbur.
4. PRRSV und virale Co-Infektionen der Atemwege
Porcines respiratorisches Coronavirus (PRCV). Die Replikation von PRCV erfolgt hauptsächlich im Epithel der unteren Atemwege. Makroskopisch erscheint die Lunge möglicherweise nicht kollabiert, jedoch mit multifokalen hellbraunen, fleckigen Veränderungen. Die Mono-Infektion mit PRCV verursacht eine mild verlaufende interstitielle Pneumonie und eine leichte nekrotisierende Bronchiolitis. Unter experimentellen Bedingungen zeigten Schweine mit einer PRCV/PRRSV-Co-Infektion eine schwerere Atemwegserkrankung und höhergradige Veränderungen an der Lunge.
Schweineinfluenza-Virus (SIV). Zielgewebe dieses Virus sind die Epithelzellen der oberen und unteren Atemwege. Es kommt zu einer Schädigung der epithelialen Auskleidung des Atemtrakts und des mukoziliären Apparates. Betroffene Lungen weisen oft eine multifokale dunkelrote bis violette Hepatisation auf. SIV beeinträchtigt auch die Funktion der Makrophagen. Dennoch zeigt sich die SIV-Replikation bei bereits mit PRRSV infizierten Schweinen nur geringfügig gesteigert.

Aujeszky´sche Krankheit (PHV-1). Die Replikaton des porcinen Herpesvirus 1 erfolgt in den alveolären Makrophagen und Monozyten und steht oft in Zusammenhang mit nekrotisierender Rhinitis und Tracheitis. Bei Tieren aus herkömmlichen Schweinebetrieben, die sowohl mit PHV-1 als auch PRRSV infiziert waren, wurden ein höherer Schweregrad und eine längere Dauer der Atemwegserkrankung beobachtet.
Porcines Circovirus Typ 2 (PCV2). PCV2 hat in den letzten Jahren an Bedeutung zugenommen. Eine auffällige Lymphadenopathie der tracheobronchiolären Lymphknoten und eine gestaute, nicht kollabierte Lunge sind der typische makroskopische Befund bei der PCV2-Infektion. Mikroskopisch zeigen sich eine milde interstitielle Pneumonie, Attenuation und Nekrose der respiratorischen Epithelzellen sowie eine peribronchioläre Fibrose des Lungengewebes und lymphozytäre Depletion. Die gleichzeitige Infektion mit PRRSV und PCV2 stellt unter Feldbedingungen ein häufiges Szenario dar, und es ist allgemein bekannt, dass die gleichzeitige Infektion mit PRRSV und PCV2 Atemwegserkrankungen fördert und den Schweregrad der pathologischen Veränderungen an Lunge und Lymphknoten erhöht. PRRSV scheint bei Schweinen mit dieser Co-Infektion insbesondere die PCV2-Infektion zu fördern und zu verlängern und die wirksame Elimination beider Viren aus dem Organismus zu erschweren.
5. PRRSV und bakterielle Co-Infektionen der Atemwege
Streptococcus suis. Dieses Bakterium kann über die oberen Atemwege oder aber infolge einer Septikämie in die Lunge gelangen. Bei betroffenen Lungen finden sich flächige Fibrinauflagerungen. Unter experimentellen Bedingungen erhöhte die PRRSV-Infektion die Empfänglichkeit der Schweine für Streptococcus suis. Forscher konnten die PRRSV-induzierte Schädigung der pulmonalen intravaskulären Makrophagen zeigen, die für die Eliminierung von Bakterien aus dem Blutkreislauf von Bedeutung sind.
Bordetella bronchiseptica. Eine Infektion mit Bordetella bronchiseptica ist bei jüngeren Schweinen häufig zu sehen. Makroskopisch zeigen sich gut abgegrenzte Bereiche dunkelroter bis violetter Hepatisation sowie geringgradige Pleuritis, insbesondere in den vorderen und unteren Lungenarealen. Bordetella bronchiseptica spielt auch bei atrophischer Rhinitis eine Rolle. Bei Schweinen, die gleichzeitig mit PRRSV infiziert waren, ließ sich eine Verschlimmerung der Erkrankung beobachten.
Pasteurella multocida (P. multocida). Bei P. multocida handelt es sich um einen häufigen, wenn nicht den häufigsten bakteriellen opportunistischen Keim, der unter normalen Umständen jedoch rasch aus der Lunge eliminiert wird. Zu den makroskopisch erkennbaren Veränderungen zählt eine rote bis graue Hepatisation der Lunge in ihren vorderen und unteren Anteilen. Vom mikroskopischen Standpunkt aus induziert die Infektion mit P. multocida eine suppurative Bronchitis unterschiedlichen Grades, oft mit einer deutlichen Ansammlung von Exsudat im Lumen der Atemwege. Unter experimentellen Bedingungen konnte bei Schweinen mit gleichzeitiger PRRSV- und P. multocida-Infektion keine eindeutige Interaktion der Erreger beobachtet werden. Da PRRSV und P. multocida jedoch zu den häufigsten Pathogenen bei Schweinen zählen und unter Feldbedingungen auch oft gemeinsam zu finden sind, ist eine Interaktion wahrscheinlich.
Mycoplasma hyopneumoniae (M. hyopneumoniae). Eine Infektion mit M. hyopneumoniae ist ziemlich häufig und die meisten Schweinebestände sind infiziert. Diese Infektion führt zu einem Verlust der Zilien des Flimmerepithels sowie zum Absterben der Epithelzellen und zu reduzierter Funktion des mukoziliären Apparates. Makroskopisch zeigt sich unter Umständen eine gering- bis hochgradige dunkelrote bis braune Hepatisation der Lunge. Zu den charakteristischen mikroskopischen Veränderungen der Lunge zählt eine peribronchioläre und perivaskuläre Lymphknotenhyperplasie. Verschiedene experimentelle Studien haben einen klaren Zusammenhang zwischen M. hyopneumoniae und PRRSV gezeigt, und man geht allgemein davon aus, dass die PRRSV-Infektion sowie die Viruslast und die pathologischen Veränderungen durch dieses Bakterium verschlimmert werden.
Actinobacillus pleuropneumoniae (APP). APP weist verschiedene Stämme auf, die sich in ihrer Virulenz signifikant voneinander unterscheiden. Betroffene Lungen zeigen eine dunkelrote bis violette Hepatisation unterschiedlichen Grades sowie Fibrinauflagerungen auf der pleuralen Oberfläche. Die pathologischen Veränderungen sind oft hochgradig und am dorsalen und kaudalen Anteil der Lunge deutlich erkennbar. Zu den typischen mikroskopischen Veränderungen zählen schwere pulmonale Blutungen und Nekrose sowie Bakterien im Verbund mit geschädigten Neutrophilen. Unter experimentellen Bedingungen war eine vorangegangene Infektion mit PRRSV nicht unbedingt nötig, damit APP das volle Spektrum der Lungenschädigung entwickelt. Erfahrungen aus der Praxis sprechen allerdings dafür, dass APP-Ausbrüche in PRRSV-infizierten Herden häufiger auftreten und auch einen schwereren Verlauf nehmen.
6. Zusammenfassung
Das PRRS-Virus ist nach wie vor der wichtigste Erreger von Atemwegserkrankungen in der globalen Schweinepopulation. Wie experimentelle Studien an mit PRRSV infizierten Schweinen belegen, kann die Mono-Infektion mit diesem Virus zwar leichte bis schwere Atemwegserkrankungen verursachen, doch kaum je mit letalem Ausgang. Die Morbidität und Mortalität ist nur dann erhöht, wenn gleichzeitig Infektionen mit einer Vielfalt an anderen Pathogenen bestehen. In den USA waren in den Jahren 2004-2007 bei den mit hoher Mortalität einhergehenden Co-Infektionen in der Regel PRRSV, PCV2 und M. hyopneumoniae beteiligt. Im Rahmen der Bekämpfung des porcinen Circovirus trug der Einsatz von Impfstoffen gegen PCV2 deutlich zur Verringerung des Schweregrades des porcinen respiratorischen Krankheitskomplexes (PRDC) bei.