La farmacocinética de la tildipirosina en las tonsilas de los cerdos
La penetración de los antimicrobianos en un órgano tan importante como la tonsila para el mantenimiento de animales portadores a múltiples agentes bacterianos es apenas conocida. El objetivo de este estudio es cuantificar la penetración de un nuevo macrólido, la tildipirosina (Zuprevo®) en las tonsilas. La tildipirosina es un análogo semisintético de la tilosina. Tiene una estructura química única que se caracteriza por dos sustituyentes de piperidina en C20 y C23, y una fracción básica de azúcar micaminosa en C5 del anillo macrocíclico de lactona. La tildipirosina ha sido aprobada para el tratamiento de enfermedades respiratorias en cerdos y ganado vacuno (EMA, 2011). Este macrólido se absorbe rápidamente y se distribuye extensamente en el lugar de la infección respiratoria. La concentración media de tildipirosina en pulmón alcanzó el pico el día 1, tras el que se observó un lento declive hasta 17 días después de la administración. (Rose et al., 2013). Además, la larga persistencia de la tildipirosina en el cuerpo se demuestra por una vida media terminal de eliminación muy prolongada de 7 días en pulmón. Como clase, los macrólidos se caracterizan por una amplia difusión en los tejidos, donde alcanzan concentraciones mucho mayores que las observadas en plasma sanguíneo. La elevada acumulación local y la larga persistencia de la tildipirosina en los pulmones hacen posible elevadas tasas de curación de los problemas respiratorios con una sola administración (Rose et al., 2013).
ACTINOBACILLUS PLEUROPNEUMONIAE
Un punto crítico en la epidemiología de Actinobacillus pleuropneumoniae (APP) es que los cerdos pueden convertirse en portadores asintomáticos de este microorganismo en sus tonsilas durante largos periodos. En la bibliografía, podemos encontrar varios ejemplos de tratamientos antimicrobianos utilizados con el fin de erradicar APP de las tonsilas, como el trabajo de Fittipaldi et al. (2005) en el que utilizaron pienso medicado con fosfato de tilmicosina durante 30 días, pero encontraron que las tonsilas de la mayoría de los animales eran PCR positivas a APP 30 días después. Otros autores tampoco fueron capaces de eliminar estas bacterias de las tonsilas (Angen et al., 2008) con la pauta de administración habitual recomendada para tulatromicina (2,5 mg/kg/una única inyección). Por último, parecía tener éxito un programa de erradicación que incluye la medicación de la cerda con enrofloxacina (una fluoroquinolona), pero no se realizaron los estudios específicos para demostrar la presencia o no de APP en las tonsilas (Bækbo, 2006). Por lo tanto, el objetivo de este estudio fue cuantificar la penetración de la tildipirosina en las tonsilas y caracterizar su perfil farmacocinético a la dosis registrada (4 mg tildipirosina/kg) como un primer paso para comprobar el posible uso de esta molécula para erradicar APP de las tonsilas en los animales portadores.
MATERIAL Y MÉTODOS
Para este estudio fueron seleccionados 48 cerdos híbridos (Landrace x Large White) de dos meses de edad, clínicamente sanos. Los animales se dividieron al azar en seis grupos —control, T1, T2 (1), T2 (5), T2 (10) y T2 (15)— de ocho animales. Los grupos T1 y T2 recibieron una dosis de 2 y 4 mg tildipirosina/ kg en inyección única, respectivamente. Los del grupo control recibieron 2 ml de solución salina (NaCl 0,9 %). El volumen de administración osciló entre 0,75 y 1 ml y entre 1,5 y 2 ml para la dosis de 2 y 4 mg de tildipirosina/kg (Zuprevo®) dependiendo del peso de los animales. Todos los tratamientos se administraron por vía intramuscular en el cuello. Los grupos se equilibraron por sexo y peso. Los animales de los grupos control, T1 y T2 (1) se sacrificaron mediante la administración intravenosa de pentobarbital sódico 24 horas después de terminar el tratamiento, mientras que los de los grupos T2 (5), T2 (10) y T2 (15) se sacrificaron a los 5, 10 y 15 días, después del tratamiento, respectivamente. En la necropsia se tomaron muestras de las tonsilas y de sangre para cuantificar la concentración de tildipirosina (Intervet Innovation GmbH, centro de investigación de MSD Animal Health en Schwabenheim, Alemania). Estas muestras se analizaron rápidamente para tildipirosina utilizando cromatografía líquida de alta resolución (HPLC) con un cartucho Spark HySphere C18 HD (Spark Holland BV, VE Emmen, Países Bajos) mediante la detección con espectrometría de masas en tándem (LC/MS/ MS) después de la extracción en fase sólida (Online- SPE). Los detalles del método de extracción en fase móvil han sido publicados previamente (Rose et al., 2013). La cuantificación de tildipirosina se realizó usando una curva estándar que consta de ocho concentraciones de tildipirosina que van desde 0,025 a 10 μg/ml (plasma) y 0,125 a 50 μg/g (homogeneizado de tonsilas). El límite inferior de cuantificación (LLOQ) fue 0,025 μg/ml (plasma) y 0,125 μg/g para las tonsilas.
Los parámetros de tildipirosina en plasma y tonsilas se determinaron sobre la base de los valores medios del grupo con un análisis no compartimental utilizando el programa informático Pharsight Win- Nonlin 5.1.1 y 5.2.1 (Pharsight Corporation, St. Louis, MO, EE. UU.). El área bajo la curva (AUC) de la concentración en plasma y tonsilas frente al tiempo (AUCplasma y AUCtonsilas) se midió a través de un método trapezoidal con interpolación lineal. El inicio de la fase de eliminación terminal se fijó 24 horas después de la administración según lo publicado previamente (Rose et al., 2013). λz se define como la constante de velocidad de primer orden asociada con la porción terminal (log-lineal) de la curva, que se estima por la regresión lineal del tiempo frente a la concentración en forma logarítmica. Por último, la vida media terminal (T1/2) se calculó como log102/λz.
Todos los análisis estadísticos se realizaron utilizando el software R (R Core Team, 2013). Para estos análisis, el cerdo (individual) fue la unidad experimental. El nivel de significación (α) se fijó en 0,05. Se utilizaron las pruebas de Shapiro-Wilk’s y Levene para evaluar la normalidad de la distribución de las variables y la homogeneidad de varianzas, respectivamente. Se eligió una prueba no paramétrica (Wilcoxon test) para comparar la diferente concentración de tildipirosina observada en el plasma y las tonsilas entre los grupos.
RESULTADOS
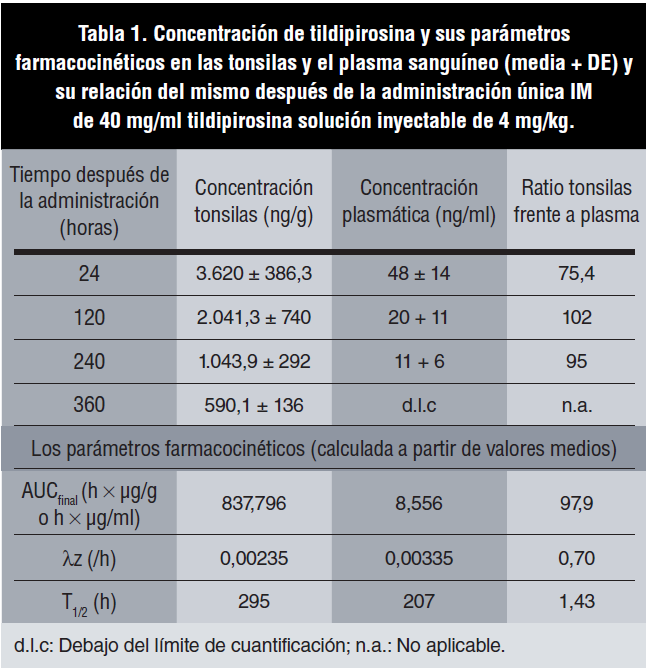
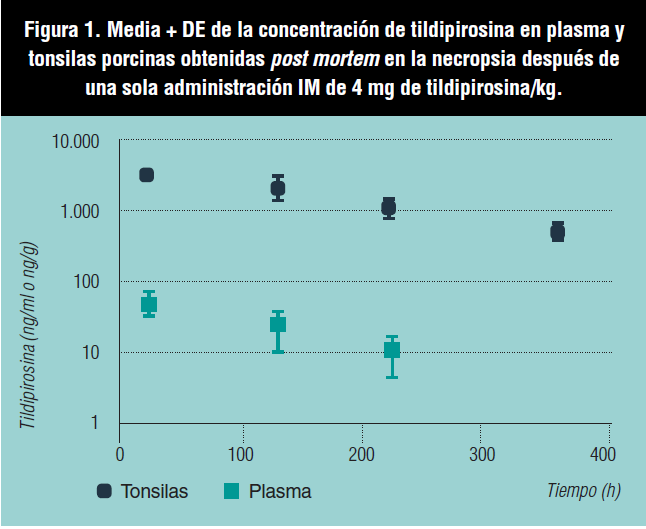
La concentración media de tildipirosina en plasma (ATPC) y tonsilas (ATTC) para el grupo control, T1, y T2 (1) aumentó significativamente (p<0,05) de forma dosis dependiente, y la relación de la concentración de tildipirosina en las tonsilas frente al plasma fue de aproximadamente 75 a las 24 horas posadministración para las dosis de 2 y 4 mg de tildipirosina/ kg. Por otra parte, la concentración en plasma fue siempre significativamente inferior (p<0,05) que en las tonsilas para los grupos tratados con 4 mg de tildipirosina/kg en 1, 5, 10 y 15 días después del tratamiento, mientras que la concentración máxima de tildipirosina en las tonsilas se observó el día 1 posadministración con una disminución gradual hasta el día 15 posadministración (figura 1). Por otra parte, la relación AUCtonsila/AUCplasma fue 97,9, y el T1/2 (h) fue claramente superior en las tonsilas en comparación con el plasma (tabla 1).
La tildipirosina ejerce un papel positivo en el tratamiento y control de la enfermedad respiratoria de las especies bovina y porcina (EMA, 2011). Esta eficacia clínica se puede explicar por la extraordinaria selectividad del pulmón y la concentración frente al perfil de tiempo de este macrólido en el tejido pulmonar (Rose et al., 2013). En el caso particular de eliminar bacterias con antimicrobianos de las tonsilas, la información generada en este estudio es necesaria para conocer el perfil farmacocinético de la tildipirosina en las tonsilas debido a que un perfil farmacocinético similar no se puede suponer entre los compartimentos de las vías respiratorias y las tonsilas. La concentración de tildipirosina en el pulmón y en el lavado broncoalveolar superó las concentraciones plasmáticas (Rose et al., 2013) como también se ha descrito para la tulatromicina en los cerdos (Villarino et al., 2013a,b). La naturaleza básica del fármaco y un grado limitado de ionización a pH fisiológico son características que favorecen la distribucióndel fármaco en compartimentos extravasculares (Cox et al., 2010). El fármaco penetra rápidamente en las vías respiratorias y las tonsilas, pero la concentración disminuye lentamente. El descenso de la concentración del fármaco en el plasma se produjo más rápido que en las vías respiratorias y las tonsilas. Este resultado puede indicar que diferentes factores, distintos de o además de la simple difusión del fármaco, desempeñan un papel en el proceso de movimiento de la tildipirosina dentro y fuera entre el plasma y los compartimentos de las vías respiratorias y las tonsilas. La relación de la concentración de tildipirosina en las tonsilas frente al plasma (75) es menor que la de pulmón frente a plasma (83) en Tmax (24 h posadministración) utilizando una dosis de 4 mg de tildipirosina/kg en una sola toma (Rose et al., 2013). En contraste, la relación AUCtonsila/AUCpulmón es 93,5 % aunque el AUCtonsila podría sobreestimarse debido a la falta de determinación de tildipirosina antes de 24 horas posadministración. En cualquier caso, este resultado sugiere que la exposición de los pulmones a este medicamento (Rose et al., 2013) es más alta que la exposición a nivel de las tonsilas.
CONCLUSIONES
Los macrólidos han sido clasificados como antimicrobianos tiempo dependientes, y es el tiempo por encima del valor de CMI (T>CMI) el parámetro PK/PD que mejor les describe. Sin embargo, para los macrólidos más recientes, como la tulatromicina, gamitromicina y tilmicosina, la relación plasmática AUC/CMI parece ser el parámetro que mejor se correlaciona con la eficacia clínica (Evans, 2005; Lees et al., 2006). En este caso, la CMI90 de la tildipirosina para las cepas de APP es 2 μg/ml (Rose et al., 2013). Sobre la base de la concentración de tildipirosina en las tonsilas y la CMI90 para APP, la concentración media de tildipirosina en las tonsilas está por encima de la CMI90 para APP durante aproximadamente 5 días. Sin embargo, esta información es insuficiente para predecir si la concentración alcanzada en las tonsilas es suficiente para eliminar esta bacteria del tejido y son necesarios estudios in vivo. Los resultados
de este estudio proporcionan una buena base para empezar a trabajar en esta área.

Agradecimientos: este estudio fue financiado por MSD Animal Health.
BIBLIOGRAFÍA
Angen Ø., Andreasen M., Nielsen E.O., Stockmarr A., Baekbo P.
(2008) Effect of tulathromycin on the carrier status of Actinobacillus
pleuropneumoniae serotype 2 in the tonsils of pigs. Veterinary
Record, 163, 445–447.
Bækbo P. (2006) Elimination of respiratory diseases – a Danish
practitioners approach. Proceedings of the 19th IPVS Congress, p.
313, 16 –19 July, Copenhagen, Denmark. vol 1.
Cox S.R., McLaughlin C., Fielder A.E., Yancey M.F., Bowersock T.L.,
Garcia-Tapia D., Bryson L., Lucas M.J., Robinson J.A., Nanjiani
I., Brown S.A. (2010) Rapid and Prolonged distribution of tulathromycin
into lung homogenate and pulmonary epithelial lining
fluid of Holstein calves following a single subcutaneous administration
of 2.5 mg/kg bodyweight. International Journal of Applied
Research in Veterinary Medicine, 8, 129–137.
EMA (2011) CVMP Assessment Report. Zuprevo® (EMEA/
V/C/002009). http://www.ema.europa.eu/docs/en_GB/document_
library/EPAR_-_Public_assessment_report/veterinary/002009/
WC500106577.pdf (accessed 29 September 2011).
Evans N.A. (2005) Tulathromycin: an overview of a new triamilide
antibiotic for livestock respiratory disease. Veterinary Therapeutics,
6, 83–95.
Fittipaldi N., Klopfstein C., Gottschalk M., Broes A., Paradis M.A.,
Dick C.P. (2005) Assessment of the efficacy of tilmicosin phosphate
to eliminate Actinobacillus pleuropneumoniae from carrier pigs.
Canadian Journal of Veterinary Research, 69, 146–150.
Lees P., Concordet D., Aliabadi F.S., Toutain P.L. (2006) Drug selection
and optimization of dosage schedules to minimize antimicrobial
resistance. In Antimicrobial Resistance in Bacteria of Animal
Origin Ed. Aarestrup, F.M., pp. 49–60. ASM Press, Washington,
DC.
R Core Team (2013) R: A language and environment for statistical
computing. R Foundation for Statistical Computing, Vienna,
Austria.
http://www.R-project.org/ (accessed 13 November 2014).
Rose M., Menge M., Bohland C., Zschiesche E., Wilhelm C., Kilp S.,
Metz W., Allan M., Röpke R., Nürnberger M. (2013) Pharmacokinetics
of tildipirosin in porcine plasma, lung tissue, and bronchial
fluid and effects of test conditions on in vitro activity against reference
strains and field isolates of Actinobacillus pleuropneumoniae.
Journal Veterinary Pharmacology Therapeutics, 36, 140–153.
Villarino N., Lesman S., Fielder A., García-Tapia D., Cox S., Lucas
M., Robinson J., Brown S.A., Martín-Jiménez T. (2013a)
Pulmonary pharmacokinetics of tulathromycin in swine. Part 2:
intra-airway compartments. Journal of Veterinary Pharmacology
and Therapeutics, 36, 340–349.
Villarino N., Lesman S., Fielder A., García-Tapia D., Cox S., Lucas
M., Robinson J., Brown S.A., Martín-Jiménez T. (2013b) Pulmonary
pharmacokinetics of tulathromycin in swine. Part I: lung
homogenate in healthy pigs and pigs challenged intra-tracheally
with lipopolysaccharide of Escherichia coli. Journal of Veterinary
Pharmacology and Therapeutics, 36, 329–339.
Kontakt:
Kontaktieren Sie uns über das folgende Formular.